Pino domestico, pino da pinoli, pino italico Pinus pinea L. Fam. Pinaceae
Sommario:
- Come riconoscerlo
- Fiori, pigne, semi
- Il portamento: da globoso a ombrello
- Nome e origine
- Esigenze climatiche, diffusione, valore identitario
- Una presenza problematica in città
- La ritrosia della chioma
- Gli aghi: un capolavoro di risparmio idrico
- Gli aghi: strumenti di una silenziosa guerra chimica
- Prodotti e sottoprodotti
- Pino marittimo? Non facciamo confusione!
- La matematica delle pigne
Come riconoscerlo
 Fig. 1. Esemplare di piazza Matteotti (Carrara). Il pino domestico, per il valore ornamentale della sua caratteristica chioma a ombrello, è molto impiegato nei parchi e nelle alberature stradali.
Fig. 1. Esemplare di piazza Matteotti (Carrara). Il pino domestico, per il valore ornamentale della sua caratteristica chioma a ombrello, è molto impiegato nei parchi e nelle alberature stradali.
Il pino domestico è talmente consueto (nelle alberature stradali, nelle pinete, nelle illustrazioni) e ha un aspetto talmente caratteristico (la chioma sempreverde a ombrello, le foglie aghiformi, la corteccia screpolata in lunghe placche, le grandi pigne cariche di pinoli) che tutti lo riconoscono a colpo d’occhio, bambini compresi.
Ma, come spesso accade, proprio la sua presenza così consueta ci induce a prestarvi poca attenzione e, di conseguenza, ad averne una conoscenza molto superficiale.
Ciò vale sia per i suoi comportamenti sia per la stessa forma. Quanti conoscono la sensibilità tattile della sua chioma, i suoi fiori, la meravigliosa struttura interna delle foglie aghiformi, i loro meccanismi di risparmio idrico, i loro strumenti di guerra chimica? Quanti hanno notato che le foglie aghiformi sono portate su minuscoli rami di circa 1 mm (brachiblasti), mentre i rami lunghi portano foglie triangolari squamiformi? Quanti sanno che i pini (come tutte le GimnospermeGimnospèrme: dal latino scientifico Gymnospermae, composto di gymno- ‘nudo’ e –spermae ‘seme’. Nome dato in botanica alle piante con semi nudi (non racchiusi in un frutto), perché derivanti da ovuli non racchiusi dentro un ovario. Comprendono, ad esempio, abeti, cipressi ecc.) producono semi, ma non frutti? Quanti sanno quando, come e perché le loro radici creano dissesto nel manto stradale? Quanti sanno che le nostre pinete, vanto dell’Italia, sono tutte di impianto artificiale?
Merita dunque osservarlo con maggior attenzione, guardarlo con occhi nuovi e scoprirne gli insospettabili segreti.
Le foglie sono lineari, aghiformi, di colore verde scuro, con apice acuto ma poco pungente, leggermente curve, riunite a coppie (Fig. 2A, 2B, 2C) entro una guaina basale rossastra (inizialmente biancastra: Fig. 2D), con le facce adiacenti piatte e quelle esterne convesse, a semicerchio (Fig. 2E). La germogliazione è tardiva (fine aprile-maggio) e le foglie raggiungono la dimensione definitiva (10-20 cm di lunghezza e 1,5-2 mm di larghezza) solo in autunno. Persistono 2-3 anni prima di cadere.
Osservandole attentamente, si nota che le foglie sono percorse per tutta la loro lunghezza da una serie di sottili linee bianche su entrambe le facce (Fig. 2F): si tratta di linee stomatiche, costituite cioè dall’allineamento di numerosi stomi (minutissimi pori dell’epidermide) che consentono gli scambi gassosi necessari alla fotosintesi (ingresso di anidride carbonica e uscita di ossigeno e vapor d’acqua).

 Fig. 2. A: le foglie aghiformi, lunghe 10-20 cm e leggermente curve, formano ciuffi all’apice dei rami. B e C: le foglie sono riunite a coppie alla base, avvolta da una guaina membranacea, bruno-rossastra a maturità e biancastra negli stadi giovanili (D).
Fig. 2. A: le foglie aghiformi, lunghe 10-20 cm e leggermente curve, formano ciuffi all’apice dei rami. B e C: le foglie sono riunite a coppie alla base, avvolta da una guaina membranacea, bruno-rossastra a maturità e biancastra negli stadi giovanili (D).E: sezione sottile di una coppia di aghi, con il lato adiacente piatto e quello esterno curvo. Le minuscole aree chiare sull’epidermide indicano alcune delle aperture delle cripte stomatiche (frecce nere), mentre lo strato sottostante (verde scuro per la clorofilla contenuta) è il tessuto fotosintetico (freccia blu). L’anatomia microscopica della foglia e le sue funzioni sono mostrate con maggior dettaglio nella microfotografia della Fig. 24. F: sia la faccia interna piatta (sopra) sia quella esterna convessa (sotto) presentano striature bianche (linee stomatiche) costituite dall’allineamento di minutissimi punti: si tratta di pori dell’epidermide (cripte stomatiche) che consentono gli scambi gassosi tra l’interno della foglia e l’aria esterna.
Per i più pignoli e curiosi, tuttavia, è doveroso precisare che il pino ha anche un secondo tipo di foglie e di rami, entrambi sconosciuti ai più.
Osservando con attenzione i giovani rami (1-3 anni), infatti, si scopre che:
- questi sono rivestiti da piccole foglie squamiformi, di colore dal giallastro al marrone (non fotosintetiche), fortemente appressate ai rametti (Fig. 3A, B e C);
- le foglie aghiformi non sono portate direttamente da questi rametti normali (detti macroblastiMacroblasto. Dal greco makrós ‘grande, lungo’ e blastós ‘germe, germoglio’: ramoscello normale, allungato, che porta foglie generalmente isolate e inserite a spirale lassa.), bensì da rametti cortissimi (detti brachiblastiBrachiblasti. Dal greco brachys ‘breve, corto’ e blastós ‘germe, germoglio’: rami cortissimi (in questo caso 1-2 mm) e inseriti in gran numero sui rami normali. Sono rami molto raccorciati e ad accrescimento definito (cioè non si allungano più): sono in pratica rami ‘nani’, sui quali perciò le foglie vengono a trovarsi così ravvicinate da mascherare la loro inserzione a spirale e da apparire disposte a ciuffetti (di soli due aghi nel caso del pino domestico.), lunghi circa 1 millimetro: Fig. 3D) che sorgono dai primi, all’ascella delle foglie squamiformi (Fig. 3C).
 Fig. 3. A, B e C: i rametti normali (macroblasti) sono rivestiti da foglie squamiformi (Sq) appressate ed embricate (dette catafilli), dalla cui ascella sorgono rametti cortissimi (brachiblasti, lunghi circa 1 mm: Br) ciascuno dei quali porta una coppia di foglie aghiformi (dette nomofilli) ricoperte alla base da una guaina comune (Gn). D: base ingrandita di due coppie di aghi, ciascuna inserita sul cortissimo brachiblasto; la guaina è stata parzialmente asportata ad arte, per mostrare l’inserimento degli aghi sul brachiblasto. Si noti che le linee stomatiche (visibili in C), sono in realtà costituite dall’allineamento di puntini bianchi (le aperture delle cripte stomatiche), già percepibili nella Fig. 2F e, ben più chiaramente, nella microfotografia della Fig. 24).
Fig. 3. A, B e C: i rametti normali (macroblasti) sono rivestiti da foglie squamiformi (Sq) appressate ed embricate (dette catafilli), dalla cui ascella sorgono rametti cortissimi (brachiblasti, lunghi circa 1 mm: Br) ciascuno dei quali porta una coppia di foglie aghiformi (dette nomofilli) ricoperte alla base da una guaina comune (Gn). D: base ingrandita di due coppie di aghi, ciascuna inserita sul cortissimo brachiblasto; la guaina è stata parzialmente asportata ad arte, per mostrare l’inserimento degli aghi sul brachiblasto. Si noti che le linee stomatiche (visibili in C), sono in realtà costituite dall’allineamento di puntini bianchi (le aperture delle cripte stomatiche), già percepibili nella Fig. 2F e, ben più chiaramente, nella microfotografia della Fig. 24).
Il tronco è eretto, cilindrico, generalmente a colonna (ma talvolta biforcato), con ramificazioni solo nella parte superiore che, negli individui maturi, formano la caratteristica chioma a ombrello. Peculiare è la mancanza di contrafforti al piede (confronta le Fig. 4A e 4D).
La corteccia è rosso-mattone con sfumature grigiastre all’esterno e di color cannella sul lato interno e sui rami giovani; negli adulti è molto spessa (anche 10 cm) e si screpola in squame lunghe e di notevole spessore (Fig. 4B e 4C).
 Fig. 4. Il tronco è cilindrico, colonnare, privo di contrafforti al piede (A), ben visibili, invece, in altre specie, tra le quali l’ippocastano (D: freccia gialla) in cui le branche principali si raccordano alle radici con evidenti colonne legnose lungo il tronco (freccia bianca). La corteccia si screpola in scaglie molto lunghe, soprattutto alla base del tronco (A) (meno lunghe verso l’apice e nei rami), di colore rosso mattone o grigio e di notevole spessore (indicato dalle frecce a doppia punta in B e C). La scaglia di corteccia in C, ancora in posto, ha almeno 25 anni: si contano infatti 25 strati di cribro.
Fig. 4. Il tronco è cilindrico, colonnare, privo di contrafforti al piede (A), ben visibili, invece, in altre specie, tra le quali l’ippocastano (D: freccia gialla) in cui le branche principali si raccordano alle radici con evidenti colonne legnose lungo il tronco (freccia bianca). La corteccia si screpola in scaglie molto lunghe, soprattutto alla base del tronco (A) (meno lunghe verso l’apice e nei rami), di colore rosso mattone o grigio e di notevole spessore (indicato dalle frecce a doppia punta in B e C). La scaglia di corteccia in C, ancora in posto, ha almeno 25 anni: si contano infatti 25 strati di cribro.
A cosa è dovuto l’aspetto caratteristico della corteccia? Come le rughe della nostra pelle, le screpolature sono un processo di invecchiamento della corteccia.
Gli alberi, infatti, crescendo, producono ogni anno un anello legnoso che ne aumenta la circonferenza: pertanto, in teoria, per lo stiramento indotto dall’ingrossamento del legno sottostante, la corteccia dovrebbe creparsi aprendo ferite nelle quali entrerebbero facilmente funghi, batteri, insetti. Per evitarlo, gli alberi producono ogni anno un nuovo strato interno della corteccia (adeguato alla maggiore circonferenza) e, gradualmente, si liberano dello strato esterno, desquamandosi.
Ma ogni albero ha un suo stile: in alcune specie (es. faggio e abete bianco) la desquamazione è continua, cosicché la corteccia resta sottile e liscia (come nei rami giovani di tutte le specie). I pini, invece, si squamano così lentamente che la corteccia aumenta di spessore e si crepa in squame grosse e spesse, il cui strato esterno può risalire a decenni prima (Fig. 4B e 4C).
Il processo è influenzato anche dalle condizioni ambientali. Nei pini isolati, più esposti al sole e ai raggi ultravioletti, la scorza invecchia prima ed è più dura sul lato rivolto al sole che, perciò, è meno flessibile e più incline a screpolarsi.
E nei rami? Come muta il loro aspetto con l’età?
Nella grande maggioranza delle specie arboree, i giovani rami hanno la corteccia liscia che diventa ruvida e inizia a desquamarsi solo con l’avanzare dell’età.
Nei pini, invece, la corteccia non è mai liscia, nemmeno nei giovani rametti. Ciò è dovuto a due fattori:
- la corteccia è ricoperta dalle foglie squamiformi (si vedano le Fig. 3A e 3B);
- la disposizione delle foglie nei pini, unica tra le conifere viventi: le foglie sono riunite in mazzetti di 1-8 aghi (2 nel pino domestico e in molti altri pini) e ciascun mazzetto è inserito su un rametto nano (brachiblasto) (Fig. 3C e 3D).
I giovani rametti di un anno, dunque, anziché essere i più lisci, sono, in proporzione, i più ruvidi di tutti. Alla caduta delle foglie con il loro brachiblasto, infatti, restano sul ramo le squame, la cui estremità, spinta verso l’esterno dal brachiblasto stesso, conferisce al rametto una spiccata scabrezza (Fig. 5A).
Negli anni successivi, l’ingrossamento del ramo e la progressiva usura delle squame conducono a una crescente riduzione della sua scabrezza (Fig. 5B, 5C e 5D), che tornerà ad aumentare nell’età adulta con lo screpolarsi della corteccia in grosse squame.
 Fig. 5. A: giovane rametto di un anno, portante una gemma (Gm) all’estremità. L’inserzione dei brachiblasti (Br) portanti gli aghi divarica la parte distale delle squame (Sq); alla caduta dei brachiblasti, pertanto, le squame divaricate conferiscono al rametto una particolare ruvidezza. B: due rametti di età crescente; dato il maggior diametro dei rami e l’iniziale usura delle squame, i rami, pur restando ruvidi, lo sono meno del rametto di un anno. C: dopo la caduta degli aghi i rami giovani restano ricoperti dalle squame (1) che, deteriorandosi con il tempo, riducono la scabrezza del ramo (2), fin quasi a scomparire (3). D: branca di maggior età: le cicatrici delle foglie squamiformi sono ormai scomparse, ma la corteccia inizia a screpolarsi; la corteccia dei rami di pino, pertanto, non è mai liscia.
Fig. 5. A: giovane rametto di un anno, portante una gemma (Gm) all’estremità. L’inserzione dei brachiblasti (Br) portanti gli aghi divarica la parte distale delle squame (Sq); alla caduta dei brachiblasti, pertanto, le squame divaricate conferiscono al rametto una particolare ruvidezza. B: due rametti di età crescente; dato il maggior diametro dei rami e l’iniziale usura delle squame, i rami, pur restando ruvidi, lo sono meno del rametto di un anno. C: dopo la caduta degli aghi i rami giovani restano ricoperti dalle squame (1) che, deteriorandosi con il tempo, riducono la scabrezza del ramo (2), fin quasi a scomparire (3). D: branca di maggior età: le cicatrici delle foglie squamiformi sono ormai scomparse, ma la corteccia inizia a screpolarsi; la corteccia dei rami di pino, pertanto, non è mai liscia.Fiori, pigne, semi
Va premesso che, sebbene le GimnospermeGimnospèrme: dal latino scientifico Gymnospermae, composto di gymno- ‘nudo’ e –spermae ‘seme’. Nome dato in botanica alle piante con semi nudi (come per es. i pinoli del pino domestico), perché gli ovuli da cui derivano non sono racchiusi dentro un ovario. (comprendenti le conifere), così come le AngiospermeAngiospèrme: dal latino scientifico Angiospermae, composto di angio- ‘vaso, recipiente’ e -spermae ‘seme’. Piante con ovuli racchiusi all’interno di un ovario, che daranno origine rispettivamente al seme e al frutto., siano piante FanerogameFanerogame: composto di fanero- ‘palese’ e –gamo ‘nozze’. Piante dotate di organi riproduttori ben visibili (es. piante a fiori), in antitesi alle Crittogame (dal greco cripto– ‘nascosto’ e –gamo ‘nozze’), es. muschi e felci., cioè piante con organi riproduttivi ben visibili e caratterizzate dalla presenza del seme (dette perciò anche SpermatofiteSpermatofite: dal greco –spermae ‘seme’ e –fito ‘pianta’). Comprendono le piante superiori più evolute, caratterizzate dal produrre il seme.), solo le angiosperme sono dotate di veri fiori. Nelle gimnosperme i ‘fiori’ hanno una struttura talmente semplice che sono più propriamente chiamati strobili o coni o pigne di sporofilliSporofillo (composto da sporo- e –fillo ‘foglia’), è il termine col quale sono indicate le foglie produttrici di spore, cioè gli organi riproduttivi maschili (microsporofilli) e femminili (macrosporofilli).
In questa sede, tuttavia, per non complicare la comprensione al lettore non specialista, parleremo di fiori maschili e femminili (come d’altronde sono denominati nel linguaggio comune e nei testi di carattere divulgativo) anziché di strobili di microsporofilli e di macrosporofilli.
Il pino è una pianta monoica (i fiori maschili e femminili sono cioè portati sulla stessa pianta) con fiori unisessuali. I fiori maschili sono costituiti da semplici squame (microsporofilli) inserite a spirale su un asse comune (Fig. 6B, 6C, 6D), a formare ‘infiorescenze’ cilindriche verdastre (rossastre alla maturità), facilmente visibili poiché situate nella parte bassa della chioma, alla base dei nuovi getti dell’anno (Fig. 6A).
Osservati in sezione longitudinale, ogni squama porta sulla faccia inferiore un paio di sacche polliniche, contenenti moltissimi granuli di polline (Fig. 6C e 6D).
I granuli di polline sono costituiti da un corpo centrale e da due sacche aerifere (vescicole anemofileAnemofilo: composto di anemo- ‘vento’ e –filo ‘amico’. Detto di piante la cui impollinazione è affidata al vento) che li rendono molto leggeri e facilmente trasportabili dal vento, nonostante le loro notevoli dimensioni (80 micronmicron. Dal greco ‘piccolo’: detto anche micromètro, è pari a un milionesimo di metro, cioè un millesimo di millimetro) (Fig. 6E e 6F).

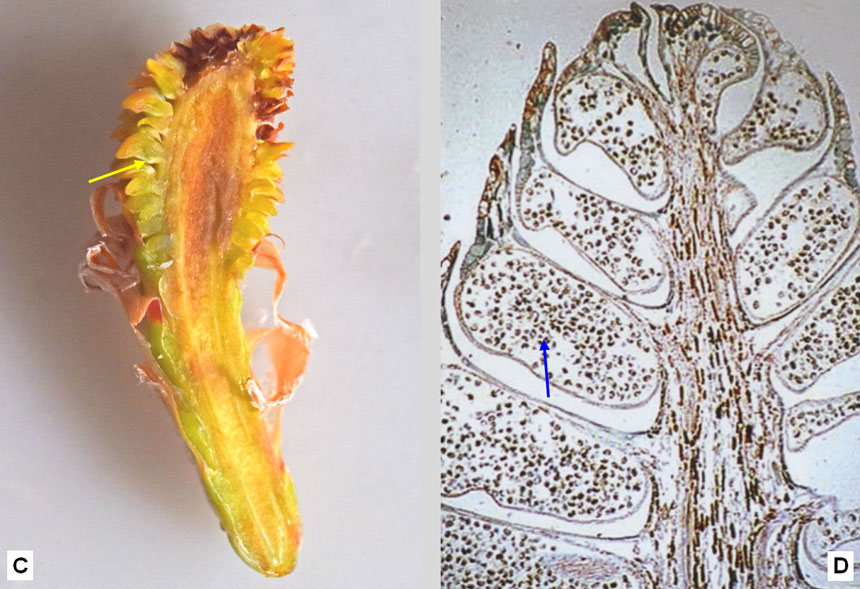
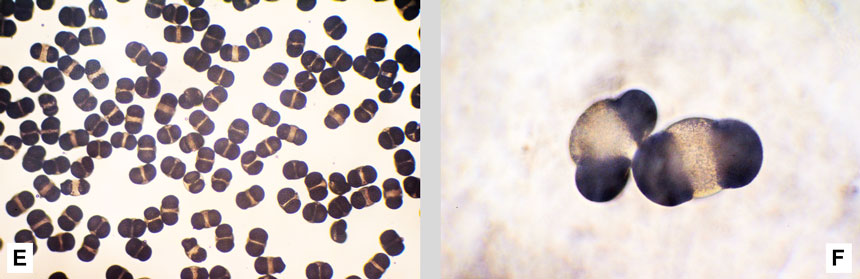 Fig. 6. Fiori maschili del pino domestico. A: le infiorescenze sono cilindriche, costituite da numerose squame fertili, rossastre a maturità. Sono collocate anche sui rami bassi, immediatamente al di sotto dei getti dell’anno che portano i nuovi aghi in via di sviluppo. B: una singola infiorescenza, con le squame (ciascuna delle quali è un fiore) inserite a spirale su un asse comune. C e D: sezione longitudinale di un’infiorescenza, vista rispettivamente in una foto a distanza ravvicinata e in una al microscopio: si noti che ogni squama porta inferiormente una sacca pollinica (freccia gialla) contenente i granuli pollinici (freccia blu). E e F: granuli pollinici visti al microscopio, rispettivamente a 100 e a 400 ingrandimenti. Ogni granulo porta due sacche aerifere che lo rendono leggero e facilmente trasportabile dal vento. Osservato dal vivo, il polline è giallo, ma al microscopio a luce trasmessa le sacche polliniche appaiono nere per la rifrazione della luce causata dall’aria in esse contenuta.
Fig. 6. Fiori maschili del pino domestico. A: le infiorescenze sono cilindriche, costituite da numerose squame fertili, rossastre a maturità. Sono collocate anche sui rami bassi, immediatamente al di sotto dei getti dell’anno che portano i nuovi aghi in via di sviluppo. B: una singola infiorescenza, con le squame (ciascuna delle quali è un fiore) inserite a spirale su un asse comune. C e D: sezione longitudinale di un’infiorescenza, vista rispettivamente in una foto a distanza ravvicinata e in una al microscopio: si noti che ogni squama porta inferiormente una sacca pollinica (freccia gialla) contenente i granuli pollinici (freccia blu). E e F: granuli pollinici visti al microscopio, rispettivamente a 100 e a 400 ingrandimenti. Ogni granulo porta due sacche aerifere che lo rendono leggero e facilmente trasportabile dal vento. Osservato dal vivo, il polline è giallo, ma al microscopio a luce trasmessa le sacche polliniche appaiono nere per la rifrazione della luce causata dall’aria in esse contenuta.
Considerata la loro scarsa visibilità, ben pochi possono vantarsi di conoscere i fiori femminili: sono, infatti, di piccole dimensioni, di colore verdastro e collocati all’estremità superiore della chioma, all’apice dei ramuli dell’anno. Il loro aspetto è quello di una pigna verde in miniatura, lunga circa mezzo centimetro (Fig. 7). Ogni squama porta due ovuli sulla superficie superiore e, al di sotto, una brattea sterile.
 Fig. 7. I fiori femminili del pino somigliano a pigne in miniatura e sono portati all’apice dei nuovi rametti dell’anno, al di sopra degli aghi in via di sviluppo. Per le piccole dimensioni, il colore verdastro e la loro collocazione nella parte più alta della chioma, sono sconosciuti ai più.
Fig. 7. I fiori femminili del pino somigliano a pigne in miniatura e sono portati all’apice dei nuovi rametti dell’anno, al di sopra degli aghi in via di sviluppo. Per le piccole dimensioni, il colore verdastro e la loro collocazione nella parte più alta della chioma, sono sconosciuti ai più.
La fioritura avviene tra marzo e maggio. Poiché, come avviene in tutte le piante anemofile, l’incontro del polline con un ovulo è lasciato ai capricci del vento, solo un’infima percentuale dei granuli pollinici riesce a cadere proprio in corrispondenza del micropilo, la microscopica apertura dell’ovulo.
È per questo motivo che i pini producono grandi quantità di polline che, liberato al minimo soffio di vento, viene trasportato anche a grandi distanze e ricopre ogni cosa di un’impalpabile polvere gialla. Basti pensare che un gruppo di infiorescenze maschili (come quello della Fig. 6A) può produrre più di un milione di granuli di polline.
Per non sprecare anche questa occasione ed evitare che il granulo pollinico appena deposto venga nuovamente portato via dal vento, all’estremità del micropilo vi è una gocciolina gommosa secreta dall’ovulo nella quale il granulo resta invischiato. Quando la goccia si essicca, ritirandosi, i granuli di polline vengono trascinati nel micropilo dell’ovulo, senza tuttavia penetrarvi direttamente.
Il granulo, infatti, emette un microscopico tubetto pollinico che penetra lentamente nell’ovulo riversandovi i suoi due nuclei spermatici, uno dei quali, fondendosi con l’ovulo, compie la fecondazione dalla quale nascerà il seme (il pinolo).
Va notato che in primavera le squame del fiore femminile si aprono per consentire al polline di raggiungere l’ovulo; dopo l’impollinazione, invece, le squame concrescono e forniscono in tal modo un elevato grado di protezione agli ovuli.
Anche una volta raggiunto l’ovulo, tuttavia, il polline deve esercitare una grande pazienza: l’ovulo, infatti, impiega due anni dall’impollinazione per maturare ed essere pronto alla fecondazione.
Al primo anno la pigna raggiunge le dimensioni di 10-13 mm e al secondo quelle di una noce; al terzo anno avviene la maturazione dei semi e nella primavera del quarto si ha l’apertura delle squame e il rilascio dei semi.
Le pigne, caduche dopo la disseminazione, sono sessili o con un breve peduncolo, bruno-rossastre, ovoidali, larghe 7-12 cm e lunghe 8-14 cm. Sono solitarie o, raramente, in gruppi di 2-3. Hanno squame legnose disposte in spirali, resinose, lucide a scudo piramidale convesso e umbone dorsale smussato (Fig. 8).
 Fig. 8. A e B: pigne di 1, 2, 3 e 4 anni; la freccia indica l’umbone dorsale smussato. C: pigna matura: tra le squame aperte sono visibili i pinoli. D: una squama distaccata con un pinolo poco sviluppato (a sinistra) e l’altro abortito (a destra); sono visibili le sottili ali biancastre del pinolo (nel pino domestico inadatte al volo).
Fig. 8. A e B: pigne di 1, 2, 3 e 4 anni; la freccia indica l’umbone dorsale smussato. C: pigna matura: tra le squame aperte sono visibili i pinoli. D: una squama distaccata con un pinolo poco sviluppato (a sinistra) e l’altro abortito (a destra); sono visibili le sottili ali biancastre del pinolo (nel pino domestico inadatte al volo).
Ogni squama porta, in fossette presenti sul lato interno, due semi eduli, oleosi, a guscio osseo rosso-scuro, avvolti da una polvere bruno-nerastra-violacea che si attacca facilmente alle dita, lunghi 15-20 mm e larghi 7-11 mm, muniti di ala brevissima e rudimentale, non fissata, che viene persa alla fuoriuscita (Fig. 9 A e 9B).
All’interno vi è una membrana cartacea rossastra che avvolge la ‘mandorla’ (la parte edule del pinolo), costituita dall’embrione avvolto da un tessuto (detto endoderma primario) che fornisce sostanze nutritizie per lo sviluppo dell’embrione stesso (Fig. 9C e 9D).
La produzione dei pinoli (impropriamente detta fruttificazione, visto che i pinoli sono semi nudi, non racchiusi entro un frutto) inizia tra 15 e 20 anni, aumenta fino a 50 e decresce rapidamente dopo gli 80; è particolarmente abbondante ogni 3-4 anni.
La giovane plantula nata dal seme possiede 10-12 foglie aghiformi embrionali (cotiledoni) lunghe circa 3 cm (Fig. 9E).
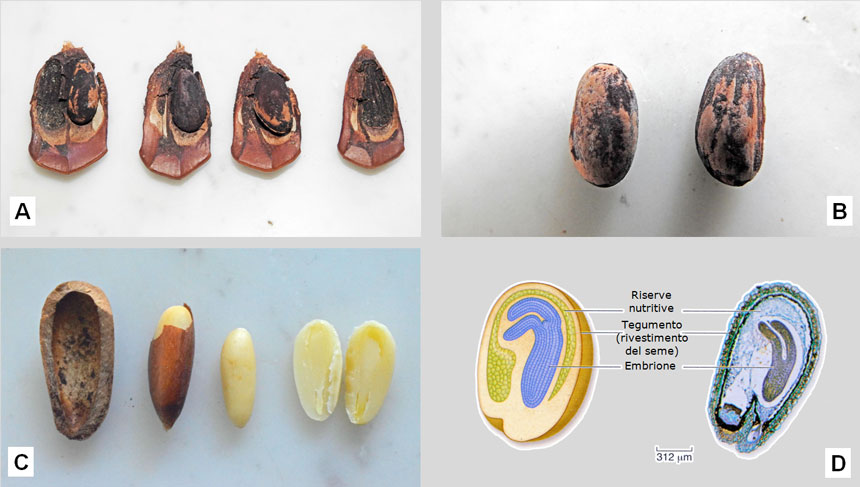
 Fig. 9. A: squame di pigna con due alloggiamenti per i pinoli. La prima squama manca di un pinolo; nelle altre tre squame si è pienamente sviluppato un solo pinolo, mentre l’altro è rimasto minuscolo. È visibile l’ala biancatra rudimentale. B: il duro guscio dei pinoli è marrone, ma ricoperto di una polverina nera. C: la ‘mandorla’ giallo chiara del pinolo è avvolta da una membrana cartacea rossastra. A destra, un seme sezionato: si intravede l’embrione, la cui struttura è mostrata in D. D: struttura del seme: a destra sezione vista al microscopio, a sinistra disegno. Nell’embrione sono visibili gli abbozzi di due aghi. E: dalla germinazione dei pinoli nasce la plantula con 10-12 foglie embrionali lunghe circa 3 cm, dette cotiledoni. F: i pinoli hanno un elevato valore commerciale. Figura D tratta da: Raven et al. Biologia. Ed. Piccin, Padova, 2013, 1368+82 pp. Fig. E tratta da: Lorenzini G. e Nali C. Il pino domestico. Leo S. Olschki Editore, Firenze, 2013, 102 pp.
Fig. 9. A: squame di pigna con due alloggiamenti per i pinoli. La prima squama manca di un pinolo; nelle altre tre squame si è pienamente sviluppato un solo pinolo, mentre l’altro è rimasto minuscolo. È visibile l’ala biancatra rudimentale. B: il duro guscio dei pinoli è marrone, ma ricoperto di una polverina nera. C: la ‘mandorla’ giallo chiara del pinolo è avvolta da una membrana cartacea rossastra. A destra, un seme sezionato: si intravede l’embrione, la cui struttura è mostrata in D. D: struttura del seme: a destra sezione vista al microscopio, a sinistra disegno. Nell’embrione sono visibili gli abbozzi di due aghi. E: dalla germinazione dei pinoli nasce la plantula con 10-12 foglie embrionali lunghe circa 3 cm, dette cotiledoni. F: i pinoli hanno un elevato valore commerciale. Figura D tratta da: Raven et al. Biologia. Ed. Piccin, Padova, 2013, 1368+82 pp. Fig. E tratta da: Lorenzini G. e Nali C. Il pino domestico. Leo S. Olschki Editore, Firenze, 2013, 102 pp.
Per il ciclo biologico del pino domestico si rimanda alla scheda Ciclo di vita delle piante verdi(Scheda in preparazione).
Il portamento: da globoso a ombrello
Lo si è già detto: il portamento tipico del pino domestico è quello con la chioma espansa ‘a ombrello’ sostenuta da un lungo ‘manico’ (il tronco, nudo per gran parte della sua lunghezza). Ma questo portamento è caratteristico solo degli esemplari maturi (Fig. 10A): la chioma, infatti, è globosa fino a 25-30 anni (Fig. 10B) e assume la forma a ombrello, grazie alla auto-potatura dei rami inferiori, solo verso i 50 anni.
 Fig. 10. A: Alberatura di pino domestico con la caratteristica chioma a ombrello (statale Aurelia, località Anderlino) e, nelle adiacenze, due giovani pini con la chioma globosa (frecce), meglio mostrati in B.
Fig. 10. A: Alberatura di pino domestico con la caratteristica chioma a ombrello (statale Aurelia, località Anderlino) e, nelle adiacenze, due giovani pini con la chioma globosa (frecce), meglio mostrati in B.
Perché il pino domestico ha un portamento a ombrello, diverso dagli altri alberi? La spiegazione sta in alcune peculiarità del pino che, pur seguendo lo schema generale delle fasi di sviluppo comuni a tutti gli alberi, devia da questo in alcuni stadi.
Per una piena comprensione dello schema generale dello sviluppo degli alberi e dei meccanismi fisiologici che lo governano si rinvia alla scheda Lo sviluppo degli alberi. In questa sede ci si limita a una breve descrizione generale e ad evidenziare le peculiarità del pino.
Lo sviluppo individuale di ogni albero segue alcune regole generali (Fig. 11), il cui risultato architettonico è schematizzabile in dieci stadi di sviluppo (indicati con numeri da 1 a 10), espressione del succedersi di quattro diverse strategie di sviluppo: crescita in altezza (stadi da 1 a 4), crescita in volume (stadi 5 e 6), mantenimento della struttura (stadi 7 e 8) e riorganizzazione dell’intera struttura (stadi 9 e10). Anche il pino domestico segue questo schema generale che però, come vedremo, non è in grado di condurre a pieno compimento a causa di alcune sue specificità.
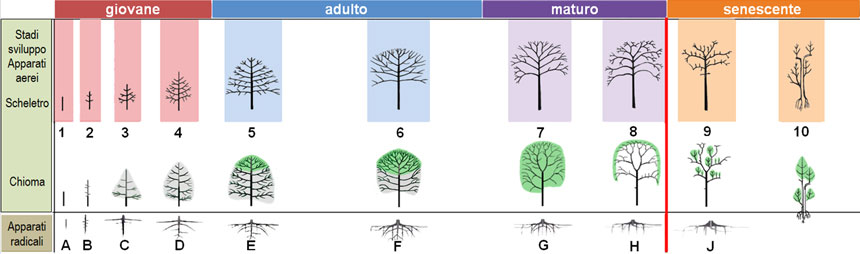 Fig. 11. Schema di sviluppo naturale della struttura arborea, in base all’evoluzione morfologica delle sue componenti aerea (stadi 1-10) e sotterranea (stadi A-J). Gli apparati aerei sono rappresentati in due righe: la prima mostra il tronco e le ramificazioni, la seconda la chioma (in grigio quella temporanea, in verde quella definitiva); si noti che allo stadio 8 la chioma forma solo uno strato periferico, mentre l’interno è privo di foglie. Nella fase giovanile (stadi 1-4) l’albero si sviluppa in altezza, assumendo una forma piramidale. Nella fase adulta (stadi 5-6) raggiunge le dimensioni massime, espandendosi in larghezza e arrotondando la chioma. La maturità (stadi 7-8) è una fase di mantenimento della chioma. Nella senescenza (stadi 9-10) la chioma si riduce e il tronco diviene cavo; spesso alcune branche si rendono indipendenti, con un proprio apparato radicale.
Fig. 11. Schema di sviluppo naturale della struttura arborea, in base all’evoluzione morfologica delle sue componenti aerea (stadi 1-10) e sotterranea (stadi A-J). Gli apparati aerei sono rappresentati in due righe: la prima mostra il tronco e le ramificazioni, la seconda la chioma (in grigio quella temporanea, in verde quella definitiva); si noti che allo stadio 8 la chioma forma solo uno strato periferico, mentre l’interno è privo di foglie. Nella fase giovanile (stadi 1-4) l’albero si sviluppa in altezza, assumendo una forma piramidale. Nella fase adulta (stadi 5-6) raggiunge le dimensioni massime, espandendosi in larghezza e arrotondando la chioma. La maturità (stadi 7-8) è una fase di mantenimento della chioma. Nella senescenza (stadi 9-10) la chioma si riduce e il tronco diviene cavo; spesso alcune branche si rendono indipendenti, con un proprio apparato radicale.Figura ricavata combinando illustrazioni di Morelli e Raimbault (2017) e di Sgherzi et al. (2016):
Morelli G., Raimbault P., 2017. Legami inscindibili. Acer, 2/2017: 25-32.
Sgherzi R., Bistoni A., Puddu G., 2016. Gazzetta Ambiente, 3/2016: 109-128.
La crescita in altezza (stadi 1-4), responsabile della formazione del tronco, avviene sotto l’influenza della dominanza apicale dell’asse principale, la cosiddetta “freccia”, sulle branche laterali. Nella maggior parte delle specie arboree, tale meccanismo si traduce in un tipico profilo conico allungato e assurgente della chioma giovanile (Fig. 11).
Nel pino domestico, invece, l’asse dominante (tronco), anche se di diametro maggiore, è più corto degli assi dominati (rami laterali): ciò porta a un tronco massiccio ma di lunghezza inferiore a quella delle branche laterali e a un profilo della chioma da subito tipicamente arrotondato (si confrontino gli stadi 3 e 4 nelle Fig. 11 e 12).
Peraltro, questo anticipato allargamento della chioma risulta ulteriormente accentuato dalla crescita privilegiata delle branche che si sviluppano sulla “faccia” inferiore o esterna degli assi principali, secondo un modo di sviluppo che prende il nome di ipotoniaIn botanica, secondo la loro inserzione sui rami laterali, i nuovi germogli vengono definiti ipotoni (dal prefisso greco hypò- ‘sotto, inferiore’ e da tono, come il tono muscolare, ma qui inteso come ‘sviluppo’) se si inseriscono sul lato inferiore (o esterno) del ramo progenitore.
Analogamente, si dicono epitoni (dal prefisso greco èpi- ‘sopra, superiore’ se si inseriscono sul lato superiore (o interno) del ramo progenitore; anfitoni (dal greco amphi- ‘attorno, da due parti’ se si inseriscono ai suoi lati, sul piano orizzontale; isotoni (dal greco isos- ‘uguale, simile, affine’) se si inseriscono tutt’attorno al ramo genitore. (stadio 5 in Fig. 12).
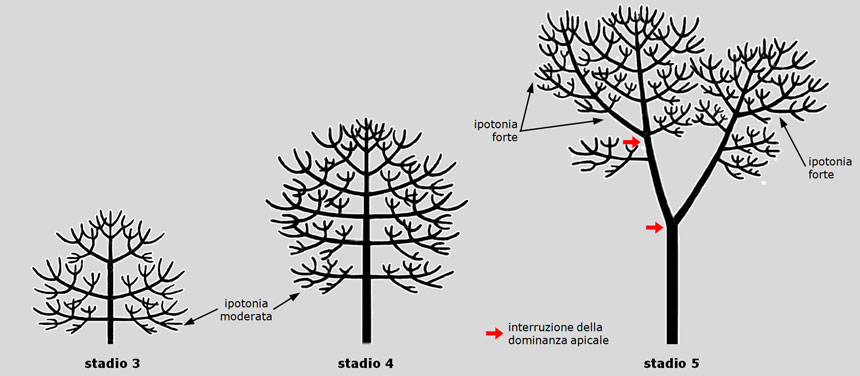 Fig. 12. Sviluppo del pino domestico. Negli stadi 3 e 4, la dominanza apicale del tronco (denominato ‘freccia’) è troppo forte per permettere lo sviluppo ipotono delle branche laterali, tutte spiccatamente plagiotropedisposte obliquamente (o trasversali) rispetto al tronco. Dal greco plágios ‘obliquo’ e –tropo, affine a trépō ‘volgere, tendenza a volgersi’. Il tronco, invece, essendo verticale, è ortotropo rispetto alla forza di gravità (dal greco orthós ‘retto, diritto’). (orizzontali). Allo stadio 5, il fisiologico indebolimento della dominanza apicale permette il progressivo sviluppo ipotono degli assi secondari e terziari. La struttura del pino rappresentato è segnata da due bruschi arresti della dominanza apicale, coincidenti con altrettanti livelli di biforcazione a tronchi ineguali (frecce rosse). Figura da: Morelli G., Raimbault P. Il pino domestico (Pinus pinea L.), un cittadino sconosciuto. Arbor, n. 2, 2014: 14-26.
Fig. 12. Sviluppo del pino domestico. Negli stadi 3 e 4, la dominanza apicale del tronco (denominato ‘freccia’) è troppo forte per permettere lo sviluppo ipotono delle branche laterali, tutte spiccatamente plagiotropedisposte obliquamente (o trasversali) rispetto al tronco. Dal greco plágios ‘obliquo’ e –tropo, affine a trépō ‘volgere, tendenza a volgersi’. Il tronco, invece, essendo verticale, è ortotropo rispetto alla forza di gravità (dal greco orthós ‘retto, diritto’). (orizzontali). Allo stadio 5, il fisiologico indebolimento della dominanza apicale permette il progressivo sviluppo ipotono degli assi secondari e terziari. La struttura del pino rappresentato è segnata da due bruschi arresti della dominanza apicale, coincidenti con altrettanti livelli di biforcazione a tronchi ineguali (frecce rosse). Figura da: Morelli G., Raimbault P. Il pino domestico (Pinus pinea L.), un cittadino sconosciuto. Arbor, n. 2, 2014: 14-26.
Nella maggior parte degli alberi, l’allungamento delle branche principali non prosegue indefinitamente. Solitamente, infatti, a un certo punto della loro crescita le branche laterali tendono a sviluppare nuove vigorose ramificazioni a partire da meristemiMeristema. Dal greco meristós ‘diviso’. In istologia vegetale, tessuto giovane costituito da cellule indifferenziate capaci di dividersi e successivamente differenziarsi per formare i tessuti definitivi.
Ne sono esempi il cambio (che genera anelli di legno verso l’esterno e di cribro verso l’interno), il fellogeno (da phellós ‘sughero’ e –geno ‘che genera’ o ‘generato da’: tessuto che produce sughero all’esterno e felloderma all’interno) e i meristemi degli apici radicali e caulinari. latenti collocati sulla loro “faccia” superiore e in posizione arretrata: questo modello di ramificazione prende il nome di epitoniain botanica, secondo la loro inserzione sui rami laterali, i nuovi germogli vengono definiti ipotoni (dal prefisso greco hypò- ‘sotto, inferiore’ e da tono, come il tono muscolare, ma qui inteso come ‘sviluppo’) se si inseriscono sul lato inferiore (o esterno) del ramo progenitore. Analogamente, si dicono epitoni (dal prefisso greco èpi- ‘sopra, superiore’ se si inseriscono sul lato superiore (o interno) del ramo progenitore; anfitoni (dal greco amphi- ‘attorno, da due parti’ se si inseriscono ai suoi lati, sul piano orizzontale; isotoni (dal greco isos- ‘uguale, simile, affine’ se si inseriscono tutt’attorno al ramo genitore..
Le ramificazioni epitone, la cui crescita è più vigorosa sia di quella dell’asse principale che dei vecchi ipotoni, destinati a morire, sono all’origine del rinnovamento progressivo della chioma allo stadio 7, inaugurando così la strategia di mantenimento della struttura arborea.
Il pino domestico, invece, non ha la tipica capacità di rinnovare la chioma per epitonia. La sua architettura, anzi, è caratterizzata da uno sviluppo ipotono talmente pronunciato e persistente che il complessivo allungamento delle branche principali si realizza per accumulo successivo di ramificazioni ipotone (cioè che si sviluppano nella parte inferiore del ramo progenitore), crescendo così verso il basso e verso l’esterno della chioma e non, come si verifica nella maggior parte delle altre specie, a causa dell’effettiva crescita in altezza dell’asse principale.
A causa dell’impossibilità fisiologica di questo rinnovamento, l’allungamento della branca può proseguire indisturbato (Fig. 13: stadio 7). Per l’albero, si tratta di una ‘condanna’ meccanica: prima o poi, infatti, l’inevitabile crollo della branca metterà fine a questo processo.
In pratica, il pino domestico, essendo incapace di un reale rinnovo della massa fotosintetizzante, finisce letteralmente per ‘morire di fame’, indebolito progressivamente dalla perdita successiva di tutte le sue branche; la senescenza del pino è quindi un fenomeno di natura squisitamente meccanica. Gli stadi 9 e 10, infatti, sono del tutto assenti, essendo del tutto preclusa al pino domestico la strategica ristrutturazione della struttura arborea.
Le peculiarità del pino domestico qui descritte spiegano dunque la sua chioma giovanile arrotondata (anziché conica), la chioma adulta espansa ad ombrello e la sua incapacità di raggiungere la senescenza.
Anche altre conifere presentano peculiarità rispetto al classico schema dei 10 stadi di sviluppo. In generale, nelle conifere il fusto diritto termina con un germoglio apicale che si riduce via via fino a scomparire del tutto.
L’abete rosso, però, conserva la ‘freccia’Freccia. Termine che, in arboricoltura, indica l’asse primario di un albero (la cima eretta). con il germoglio che esercita la dominanza apicale: si mantiene dunque per tutta la vita allo stadio di sviluppo 3. È per questo motivo che la sua chioma è sempre conica (profilo triangolare).
L’abete bianco, al contrario, cresce in larghezza anche là in alto, tanto che sembra che un grosso uccello vi abbia costruito il nido (fenomeno noto agli specialisti come ‘chioma a nido di cicogna’).
Il pino domestico, come si è visto, sviluppa una coronaCorona: punto dove la chioma dell’albero raggiunge la massima espansione laterale. molto ampia ed è privo di una punta riconoscibile.
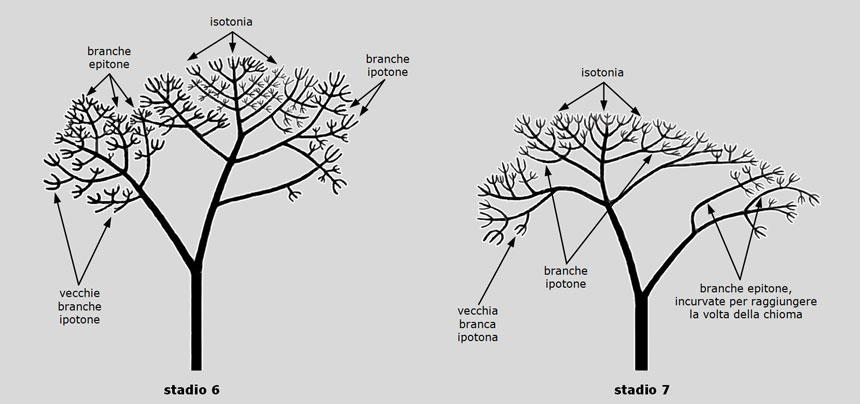 Fig. 13. Sviluppo del pino domestico. Allo stadio 6, l’ormai marginale azione della dominanza apicale porta, nel giro di alcuni anni, allo sviluppo isotono delle branche principali; l’ipotonia resta fortemente rappresentata solo sulle branche secondarie. Si osserva anche una precoce comparsa dell’epitonia sul tronco secondario inclinato, frutto di un primitivo disturbo della dominanza apicale. Allo stadio 7, l’isotonia si generalizza alle estremità delle branche principali, le cui ramificazioni secondarie, tuttavia, mantengono una spiccata ipotonia. Le branche più basse, invece, sviluppano contemporaneamente ed in reciproca concorrenza, sia un asse principale che si raddrizza isotonicamente, che delle branche epitone che si incurvano verso la luce; sopravvivono anche i vecchi ipotoni. Figura da: Morelli G., Raimbault P. Il pino domestico (Pinus pinea L.), un cittadino sconosciuto. Arbor, n. 2, 2014: 14-26.
Fig. 13. Sviluppo del pino domestico. Allo stadio 6, l’ormai marginale azione della dominanza apicale porta, nel giro di alcuni anni, allo sviluppo isotono delle branche principali; l’ipotonia resta fortemente rappresentata solo sulle branche secondarie. Si osserva anche una precoce comparsa dell’epitonia sul tronco secondario inclinato, frutto di un primitivo disturbo della dominanza apicale. Allo stadio 7, l’isotonia si generalizza alle estremità delle branche principali, le cui ramificazioni secondarie, tuttavia, mantengono una spiccata ipotonia. Le branche più basse, invece, sviluppano contemporaneamente ed in reciproca concorrenza, sia un asse principale che si raddrizza isotonicamente, che delle branche epitone che si incurvano verso la luce; sopravvivono anche i vecchi ipotoni. Figura da: Morelli G., Raimbault P. Il pino domestico (Pinus pinea L.), un cittadino sconosciuto. Arbor, n. 2, 2014: 14-26. Fig. 14. Il ‘pinone’ di Lacona (Isola d’Elba), un maestoso esemplare di pino domestico: circonferenza tronco 4,3 m; larghezza chioma 30 m; età circa 250 anni.
Fig. 14. Il ‘pinone’ di Lacona (Isola d’Elba), un maestoso esemplare di pino domestico: circonferenza tronco 4,3 m; larghezza chioma 30 m; età circa 250 anni.
Il pino domestico è un albero sempreverde di seconda grandezzaSecondo l’altezza raggiunta, gli alberi sono definiti di prima grandezza (altezza superiore a 30 metri), seconda grandezza (altezza 20-30 m) e terza grandezza (altezza inferiore a 20 m). Quelli inferiori a 8 (10) m sono definiti piccoli alberi. (raggiunge cioè un’altezza di 20-30 m) che può superare il diametro di 1 m.
Non è una pianta particolarmente longeva: supera facilmente il secolo d’età ma, in ambiente urbano, già dopo gli 80 anni comincia a presentare problemi di stabilità dei rami. Alcuni esemplari, tuttavia, superano 250 anni (Fig. 14).
Non è comunque molto, se si pensa che Pinus longaeva delle White Mountains della California è il più antico albero vivente: l’età di un esemplare è stata stimata di 4.900 anni!
Nome e origine
Il nome deriva dal latino pinus (greco pity) e dal sanscrito pit, vocaboli che significano resina. L’epiteto specifico pinea replica il nome generico, come a significare “pino per eccellenza”.
Il genere Pinus comprende oltre cento specie, 10 delle quali presenti in Italia, quasi tutte utilizzate a scopo ornamentale e forestale. P. pinea ha una notevole uniformità genetica; è nota la sua incompatibilità d’incrocio con tutti gli altri pini.
L’origine del genere Pinus risale a 225 milioni d’anni fa, in Asia orientale. Il gruppo dei pini mediterranei (pino domestico P. pinea, pino d’Aleppo P. halepensis, pino marittimo P. pinaster) si sarebbe staccato 96 milioni d’anni fa, procedendo verso occidente lungo un percorso a sud della catena hymalayana.
Durante l’ultima glaciazione (Würm, da 75.000 a 12.000 anni fa), P. pinea avrebbe trovato rifugio nella penisola iberica, aiutata nella dispersione dalla gazza azzurra (Cyanopica cyanus), per l’abitudine di nascondere i pinoli nel suolo, come provviste. Quindi gli uomini preistorici avrebbero diffuso quei semi lungo il Mediterraneo, forse come primo albero da “frutto”. Secondo altre ipotesi, sarebbe stato diffuso dai Fenici, dagli Etruschi, dagli Elleni.
Anche se mancano evidenze di un’introduzione antropica nel bacino del Mediterraneo, i botanici non hanno ancora chiarito se il pino domestico nelle nostre aree è autoctonoAutoctono: dal greco autóchton, composto di auto- ‘stesso’ e chtón ‘terra’. Riferito alle specie (o alle popolazioni umane) che si sono originate nello stesso luogo dove attualmente abitano.. In ogni caso, data la sua presenza da lungo tempo, va considerato quantomeno un’archeofitaArcheofita: dal greco archâios ‘antico’ e phytón ‘pianta’. Pianta introdotta dall’uomo in epoca remota (prima della scoperta dell’America, per convenzione prima del 1500).. Testimonianze fossili ne avrebbero accertato la presenza nel primo Pliocene (5 milioni d’anni fa), ma non è certo se, in seguito, sia scomparso e, più tardi, sia stato reintrodotto dall’uomo.
A prescindere da questi dubbi, è comunque pacifico che il pino sia stato coltivato abbondantemente sin dal tempo dei Romani (forse anche dagli Etruschi). Il pino ha acquisito universalmente cittadinanza in Italia (tanto da essere stato anche definito Pinus italica) e fa parte da ‘sempre’ del paesaggio italiano, trovando in parecchie zone il suo habitat ideale. L’antichità delle pinete litoranee ha plasmato così fortemente l’identità territoriale che le attuali pinete costiere, pur essendo impianti artificiali, si sono trasformate in vanto e peculiarità ambientale di varie aree.
Possiamo quindi far partire dall’epoca romana l’avventura certa del pino domestico in Italia. Il pino era molto apprezzato per la sua multifunzionalità: per il legname (ottimo per la costruzione di imbarcazioni), per i pinoli (considerati una vera leccornia) e per impieghi medicinali. I Romani diffusero largamente il pino lungo i litorali, specialmente in prossimità degli arsenali navali (le cosiddette ‘classi’: la pineta di Ravenna oggi suddivisa tra Classe, San Vitale e Cervia, ne è un esempio magistrale).
Nei secoli successivi molte delle aree occupate dalle pinete divennero zone malariche e paludose, raggiungendo la massima decadenza intorno al 1200-1300. Nel XVII sec. le pinete ritroveranno un loro ruolo funzionale: furono impiantate per proteggere dal vento salmastro le coltivazioni agricole dell’immediato entroterra. Nell’Ottocento, con lo sviluppo dei primi sistemi razionali di gestione del bosco, le pinete furono trasformate in vere monocolture da frutto. Oggi si tende a farle evolvere per valorizzarne gli aspetti naturalistici.
Esigenze climatiche, diffusione, valore identitario
Il pino domestico è una specie termofilaTermofilo. Dal greco thermós ‘caldo’ e phílos ‘amico’: che vive preferenzialmente in ambienti caldi., piuttosto sensibile alle temperature minime, moderatamente xerofilaXerofilo. Dal greco xerós ‘secco, arido’ e phílos ‘amico’: organismo che vive preferibilmente negli ambienti aridi. (risente però di siccità molto prolungate) e spiccatamente eliofila Eliofilo. Dal greco hēlios ‘sole’ e phílos ‘amico’: pianta (detta anche fotòfila ‘che ama la luce’) che vegeta bene alla luce diretta e forte del sole (per es. gli arbusti sempreverdi della macchia mediterranea, come il lentisco). (come dimostrato dalla chioma espansa a ombrello), anche se da giovane si deve sviluppare in un sottobosco rado e ombroso.
Le variabili ecologiche che ne regolano la distribuzione sono la temperatura media del mese più freddo (che condiziona la sopravvivenza) e le precipitazioni invernali, che incidono sui tassi di accrescimento.
La sua fascia climatica è quella più calda dell’area mediterranea, dove si spinge dalla costa nelle zone interne fino a 500-600 m di altitudine (1.000 nelle isole); rientra dunque nella zona del Lauretum, con sconfinamenti nei settori più caldi del Castanetum. L’areale si estende quindi dall’Anatolia al Portogallo e all’Algeria. Al di fuori dell’Europa è naturalizzato in California e in Sud Africa.
Poco esigente nei riguardi del suolo, preferisce i terreni sabbiosi o freschi, adattandosi anche ad altri tipi, esclusi quelli argillosi e compatti, acquitrinosi e salini.
Il suo habitat ideale è in prossimità del mare. Solo il pino, infatti, con il leccio in sottochioma, riesce a colonizzare i suoli sabbiosi costieri, aridi in estate, privi di sostanza organica e spazzati dai venti marini. Proprio per tale ragione il pino domestico è stato massicciamente impiegato durante le varie fasi di bonifica, per costituire una fascia di protezione dai venti delle retrostanti colture.
In Italia il pino caratterizza buona parte del litorale toscano, ma si trova anche disperso nelle colline interne, per lo più in formazioni miste. Fra le più importanti pinete costiere pure (zone a parco o ad alta frequentazione turistica) vi sono quelle di Viareggio, Migliarino, San Rossore, Tombolo, Follonica, Alberese, Castel Fusano, Fiumicino; sull’Adriatico spiccano quelle di Ravenna e di Aquileia. Il modello selvicolturale prevalente è quello del bosco coetaneo costituito da particelle sistematicamente avvicendate al taglio raso.
La superficie totale (mondiale) coperta dal pino domestico è stimata intorno a 380.000 ettari, suddivisi per il 75% in Spagna, 9% in Portogallo e Turchia, 5% Italia e percentuali trascurabili in Grecia, Libano e Francia. Nel resto d’Europa le pinete sono assenti.
Il paese d’elezione è dunque la Spagna. Merita precisare che tutte le pinete litoranee italiane sono state piantate artificialmente, in sostituzione della lecceta. Tuttavia l’intenso uso ornamentale del pino in Italia, impiegato fin dai Romani nelle alberature della via Aurelia, della via Appia e di altre strade consolari, nelle aree monumentali (si pensi al Foro Italico) e nelle pinete litoranee, ha fatto sì che il viaggiatore che attraversava l’Italia sia stato sempre accompagnato dalla vista dei pini che ne hanno talmente caratterizzato il paesaggio da giungere a denominare il pino domestico anche Pinus italica.
Ciononostante e paradossalmente, il paesaggio delle pinete di pino domestico ci è talmente consueto che siamo portati a considerarlo una presenza normale, quasi banale: spesso non siamo consapevoli del valore unico che abbiamo ereditato dalla storia.
Eppure la copertura complessiva delle pinete in Italia è valutata in circa 20.000 ettari, due terzi dei quali (13.000 ha) in Toscana. Pertanto (analogamente al cipresso che, pur non essendo autoctono, caratterizza in modo inconfondibile il paesaggio delle colline toscane, tanto da renderlo famoso nel mondo), il pino domestico riveste un particolare valore identitario per la Toscana e, ancor di più, per Carrara.
Carrara, infatti, è la prima città in cui il turista europeo che scende in Italia incontra le pinete, ricevendone un chiaro messaggio: «Caro europeo, benvenuto a Carrara, la prima città in cui incontri le pinete. Hai il privilegio di star entrando in Toscana, la regione che ospita i due terzi delle pinete d’Italia, la patria del pino domestico. Goditi il suo incomparabile valore paesaggistico e la lunga storia che ti racconta».
La necessità di tutelare questo valore identitario richiede non solo il mantenimento dei pini nelle alberature di strade di particolare importanza paesaggistica (quali la statale Aurelia e il Viale Colombo, il ‘biglietto da visita’ di Marina di Carrara), ma anche il reintegro degli esemplari caduti nel corso degli anni.
In queste strade, infatti, il valore identitario supera di gran lunga gli inconvenienti del dissesto del manto asfaltato causato dal pino laddove le sue radici sono sottoposte alla pressione delle auto in sosta o in transito.
Una presenza problematica in città
Nonostante il suo elevato valore paesaggistico, l’impiego del pino domestico nelle alberature urbane comporta varie problematiche, la più importante delle quali è il dissesto dei marciapiedi e del manto stradale, che vengono sollevati dalle radici.
Va osservato che i pini piantati in terreno aperto o in aiuole spaziose adiacenti a strade prive di traffico intenso e senza posteggio ravvicinato non provocano sollevamenti del suolo (Fig. 15) che, invece, diventa marcato dove le radici superficiali del pino sono sottoposte ad una pressione orientata, quale quella esercitata dal peso dei veicoli in sosta o in transito.
 Fig. 15. A: l’apparato radicale dei pini in un parco non è soggetto alla pressione del traffico e del parcheggio: non sviluppa pertanto i noduli radicali che sollevano il terreno. B: anche i pini dotati di un’aiuola spaziosa non generano particolari problemi di dissesto stradale.
Fig. 15. A: l’apparato radicale dei pini in un parco non è soggetto alla pressione del traffico e del parcheggio: non sviluppa pertanto i noduli radicali che sollevano il terreno. B: anche i pini dotati di un’aiuola spaziosa non generano particolari problemi di dissesto stradale.
In tal caso, infatti, le radici superficiali sviluppano particolari noduli che si ingrossano e sollevano il suolo (Fig. 16).
 Fig. 16. La compressione delle radici esercitata da una pressione orientata (il peso di veicoli in sosta o in transito) induce lo sviluppo e l’ingrossamento dei noduli radicali (A) e la conseguente fuoriuscita delle radici dal suolo (B). Quando il suolo è coperto da asfalto o altre pavimentazioni, queste subiscono un marcato dissesto (C e D).
Fig. 16. La compressione delle radici esercitata da una pressione orientata (il peso di veicoli in sosta o in transito) induce lo sviluppo e l’ingrossamento dei noduli radicali (A) e la conseguente fuoriuscita delle radici dal suolo (B). Quando il suolo è coperto da asfalto o altre pavimentazioni, queste subiscono un marcato dissesto (C e D).
Per comprendere la ragione di tale risposta radicale alla pressione bisogna tener conto della struttura dell’apparato radicale del pino e del ruolo fisiologico dei noduli radicali.
Va considerato che i pini mediterranei si sono evoluti per colonizzare substrati poveri, ben drenati, areati fino in profondità e, soprattutto, più o meno incoerenti. Generalizzando, i pini domestici prediligono le ghiaie e i pini marittimi le sabbie: entrambi sono substrati infidi, poco adatti a sostenere grandi alberi.
La strategia del pino per crescere su un substrato così instabile è quella di “consolidare” il sito di radicazione, ancorando tra loro le particelle minerali grazie all’estesa impalcatura tridimensionale dell’apparato radicale. L’apparato radicale del pino domestico cresciuto indisturbato è, infatti, tra i più profondi che si conoscano e offre così una formidabile capacità di ancoraggio anche su terreni di per sé poco stabili.
Tale apparato è costituito da un poderoso fittone verticale con numerose radici fascicolate orizzontali dalle quali partono nuovi fittoni verticali. Si viene così a creare un sistema di più palchi orizzontali, a diversa profondità, rinforzato da fittoni verticali. Le radici corda, infine, più sottili e numerose, vanno in tutte le direzioni, completando il consolidamento del volume di terreno interessato (Fig. 17).
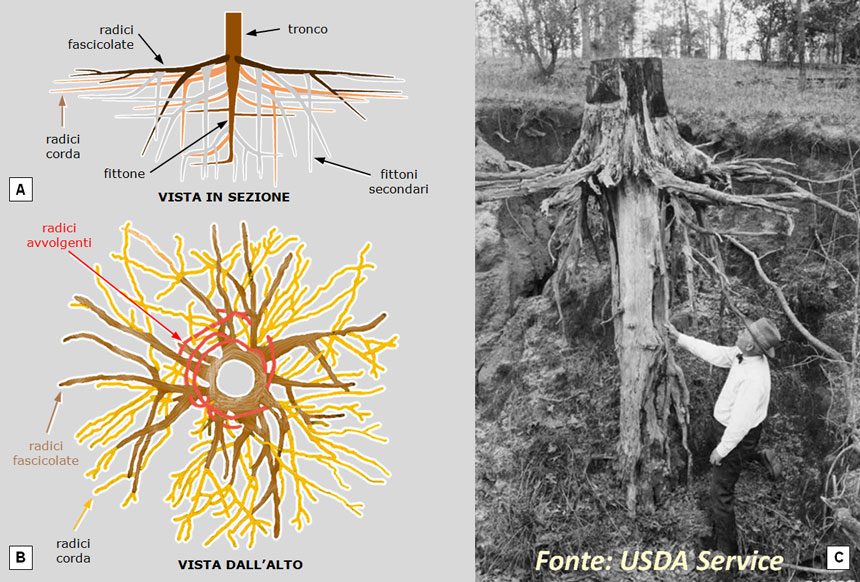 Fig. 17. L’apparato radicale del pino è costituito da un fittone verticale, più palchi orizzontali di radici fascicolate (dalle quali si dipartono fittoni secondari) e da radici corda superficiali (di diametro costante) che si dirigono orizzontalmente in tutte le direzioni. Gli esemplari allevati in vaso presentano anche radici avvolgenti che, con la crescita, divengono strozzanti (si veda la Fig. 19B). A: vista in sezione verticale. B: vista in pianta (dall’alto). C: il fittone principale è veramente poderoso e proporzionato alle dimensioni della parte aerea.
Fig. 17. L’apparato radicale del pino è costituito da un fittone verticale, più palchi orizzontali di radici fascicolate (dalle quali si dipartono fittoni secondari) e da radici corda superficiali (di diametro costante) che si dirigono orizzontalmente in tutte le direzioni. Gli esemplari allevati in vaso presentano anche radici avvolgenti che, con la crescita, divengono strozzanti (si veda la Fig. 19B). A: vista in sezione verticale. B: vista in pianta (dall’alto). C: il fittone principale è veramente poderoso e proporzionato alle dimensioni della parte aerea.
Un ruolo importante nel consolidamento del terreno è svolto dai ‘noduli radicali’ (Fig. 16A), rigonfiamenti che si formano sulle radici corda la cui funzione è sia quella di un palloncino che si gonfia premendo sugli elementi rigidi e inamovibili presenti nel substrato (irrobustendo l’ancoraggio dell’albero), sia quella di consolidamento tra gli elementi dispersi e incoerenti.
Una accentuata formazione di noduli si innesca quando le radici corda sono soggette ad un carico orientato, carico che, talvolta, aumenta proprio in seguito alla formazione del nodulo; in questo modo si genera una sorta di reazione a catena che porta alla sovrapposizione di diverse generazioni di noduli, anastomizzati tra loro e frammisti ad elementi inerti.
Si formano così estesi ‘scudi nodulari’ che esercitano una formidabile azione stabilizzatrice del substrato. Se però il substrato naturale è ‘soffocato’ da una pavimentazione stradale sottoposta al traffico veicolare (o anche a un calpestio particolarmente intenso), il rigonfiamento dei noduli per stabilizzare il substrato si traduce nel sollevamento e nella demolizione della pavimentazione stessa.
Il dissesto delle pavimentazioni rende dunque problematico un largo impiego del pino nelle alberature urbane. Per i nuovi impianti il problema può essere affrontato predisponendo cupole sorrette da pilastri di sostegno che sopportino il peso dei veicoli, proteggendo così il terreno dalla pressione (Fig. 18A).
Un altro metodo, meno artificiale, impiega come substrato una miscela di ciottoli e di terreno vegetale fine, ottenendo così una ‘rottura della granulometria’: i ciottoli a contatto tra di loro, sorreggendo il peso dei veicoli, fanno da struttura portante e proteggono dalla compressione il terreno fine presente negli interstizi, che può così essere colonizzato dalle radici senza dar luogo all’eccessiva formazione di noduli radicali (Fig. 18B).
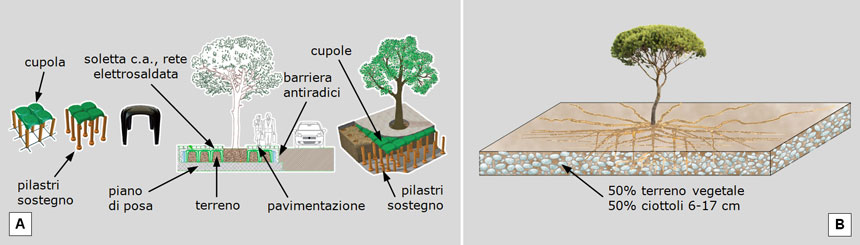 Fig. 18. Sistemi per evitare la compressione del terreno e la conseguente eccessiva formazione di noduli radicali che dissestano le pavimentazioni. A: l’approccio tecnologico Cupolex (brevetto Pontarolo Engineering) prevede la rimozione del suolo, l’allestimento di un piano di posa in cemento, la collocazione di pilastri di sostegno, il riempimento con terreno vegetale, la sua copertura con cupole incastrate sui pilastri, una soletta in cemento armato con rete elettrosaldata e, infine, la pavimentazione. B: un sistema meno artificioso utilizza ciottoli per sorreggere la pressione esercitata dai veicoli, in modo che le radici possano crescere nel terreno presente tra gli interstizi dei ciottoli, senza essere sottoposte a pressione. Fonte delle illustrazioni: A: da Pontarolo Engineering (https://pontarolo.com/prodotti/cupolex/). B: Legambiente Carrara, ispirata alla relazione di Pierre Raimbault al Seminario “La gestione degli alberi in città”, Sanremo, nov. 1996.
Fig. 18. Sistemi per evitare la compressione del terreno e la conseguente eccessiva formazione di noduli radicali che dissestano le pavimentazioni. A: l’approccio tecnologico Cupolex (brevetto Pontarolo Engineering) prevede la rimozione del suolo, l’allestimento di un piano di posa in cemento, la collocazione di pilastri di sostegno, il riempimento con terreno vegetale, la sua copertura con cupole incastrate sui pilastri, una soletta in cemento armato con rete elettrosaldata e, infine, la pavimentazione. B: un sistema meno artificioso utilizza ciottoli per sorreggere la pressione esercitata dai veicoli, in modo che le radici possano crescere nel terreno presente tra gli interstizi dei ciottoli, senza essere sottoposte a pressione. Fonte delle illustrazioni: A: da Pontarolo Engineering (https://pontarolo.com/prodotti/cupolex/). B: Legambiente Carrara, ispirata alla relazione di Pierre Raimbault al Seminario “La gestione degli alberi in città”, Sanremo, nov. 1996.
Un altro importante accorgimento è piantare pini di dimensioni contenute, resistendo alla tentazione degli impianti a ‘pronto effetto’ ornamentale. Le potature di allevamento in contenitore e i trapianti in vivaio, infatti, comportano ripetute mutilazioni del fittone e delle radici laterali, cui consegue la disorganizzazione architettonica del pino (Fig. 19).
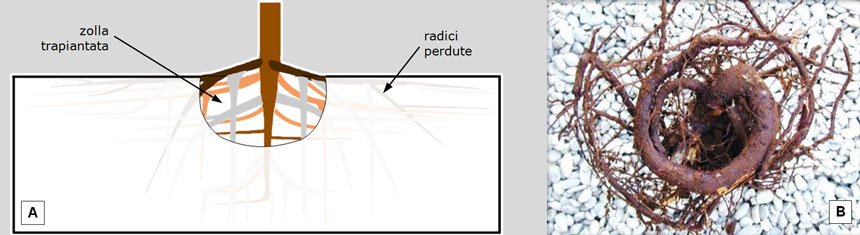 Fig. 19. A: Ad ogni trapianto in vivaio, il prelievo della zolla comporta la mutilazione del fittone (e, di conseguenza, una minor altezza del futuro tronco) e delle radici laterali (e, di conseguenza, la precoce formazione di palchi rameali più bassi). B: l’allevamento in contenitore costringe le radici a crescere lungo le sue pareti; si sviluppano così radici ‘avvolgenti’ che, in seguito, diverranno ‘strozzanti’. Fonte delle illustrazioni: A: Legambiente Carrara. B da: G. Morelli e P. Raimbault. Pino domestico in ambito urbano. Un cittadino sconosciuto. Acer, n. 3/2011: 20-30.
Fig. 19. A: Ad ogni trapianto in vivaio, il prelievo della zolla comporta la mutilazione del fittone (e, di conseguenza, una minor altezza del futuro tronco) e delle radici laterali (e, di conseguenza, la precoce formazione di palchi rameali più bassi). B: l’allevamento in contenitore costringe le radici a crescere lungo le sue pareti; si sviluppano così radici ‘avvolgenti’ che, in seguito, diverranno ‘strozzanti’. Fonte delle illustrazioni: A: Legambiente Carrara. B da: G. Morelli e P. Raimbault. Pino domestico in ambito urbano. Un cittadino sconosciuto. Acer, n. 3/2011: 20-30.
Per inciso, merita ricordare che il fittone è connesso al tronco principale e le radici fascicolate sono connesse ai grandi palchi di rami. Data questa connessione anatomica e funzionale, i danni a carico delle radici fascicolate hanno ripercussioni dirette sulla vitalità e sull’organizzazione architettonica dei palchi, mentre i danni a carico del fittone compromettono lo sviluppo del tronco principale.
In altre parole, l’aspetto esteriore del pino riflette ciò che è accaduto al di sotto del piano di campagna. Pertanto, se vogliamo pini ben conformati, sani e stabili dobbiamo lasciare in pace le radici. Se i pini allevati in contenitore sono assolutamente da bandire, anche i ripetuti trapianti della zolla in vivaio comportano la mutilazione del fittone (che non ricresce) e, perciò, un tronco poco sviluppato in altezza.
La conseguenza più evidente è la ‘impalcatura’ dell’albero (la formazione precoce dei grandi palchi) che, unita ad un tronco più corto, impedisce di ottenere i grandi pini della nostra tradizione paesaggistica (Fig. 20).
 Fig. 20. Un filare di pini di altezza inferiore a quella attesa in base al diametro del tronco (Carrara, via Maestri del Marmo). Con ogni probabilità, si tratta di esemplari il cui fittone ha subito ripetuti tagli nel corso dei trapianti di allevamento in vivaio precedenti all’impianto e che, perciò, anche in futuro non riusciranno a diventare maestosi.
Fig. 20. Un filare di pini di altezza inferiore a quella attesa in base al diametro del tronco (Carrara, via Maestri del Marmo). Con ogni probabilità, si tratta di esemplari il cui fittone ha subito ripetuti tagli nel corso dei trapianti di allevamento in vivaio precedenti all’impianto e che, perciò, anche in futuro non riusciranno a diventare maestosi.
Altre problematiche, comuni anche ad altri alberi in ambito urbano, sono conseguenza della preparazione della sola buca d’impianto (anziché rendere sciolta una zolla molto ampia, per favorirne la colonizzazione radicale) e del danneggiamento delle radici nel corso di lavori di scavo per la posa di cavi, fognature, tubazioni.
La ritrosia della chioma
Stando con il naso all’insù in una pineta possiamo scoprire che le chiome, sebbene siano molto ravvicinate, non si toccano. Spesso, addirittura, i rami, giunti in prossimità della chioma dell’esemplare adiacente, compiono vistose curvature di allontanamento (Fig. 21).
 Fig. 21. Esempi di “ritrosia delle chiome” nella pineta di Marina di Carrara. Data la sovrapposizione ottica delle chiome di esemplari posti a diversa distanza, la ritrosia non è immediatamente percepibile a colpo d’occhio; per tale motivo, sulle stesse foto, replicate a destra e fortemente schiarite, sono state riportate le curvature più manifeste dei rami. Osservando attentamente ogni curvatura è possibile comprendere come essa sia una reazione di allontanamento da una chioma vicina. La freccia blu mostra la reazione di allontanamento da una chioma oggi non più esistente (per la caduta dell’albero sovrastante).
Fig. 21. Esempi di “ritrosia delle chiome” nella pineta di Marina di Carrara. Data la sovrapposizione ottica delle chiome di esemplari posti a diversa distanza, la ritrosia non è immediatamente percepibile a colpo d’occhio; per tale motivo, sulle stesse foto, replicate a destra e fortemente schiarite, sono state riportate le curvature più manifeste dei rami. Osservando attentamente ogni curvatura è possibile comprendere come essa sia una reazione di allontanamento da una chioma vicina. La freccia blu mostra la reazione di allontanamento da una chioma oggi non più esistente (per la caduta dell’albero sovrastante).
Si tratta della ‘ritrosia delle chiome’ (o ‘timidezza delle chiome’), un fenomeno non comune (in generale, infatti, gli alberi non sono per nulla timidi e tendono a intrecciare le loro chiome), ma presente in alcune famiglie, ad esempio Pinacee, Fagacee e Mirtacee.
Sebbene non sia chiaro perché e come ciò accada, secondo alcuni ricercatori questo fenomeno implica una comunicazione tra piante che, informatesi della reciproca presenza, pattuiscono una spartizione dello spazio per non disturbarsi a vicenda.
Sebbene le piante siano in grado di comunicare tra loro con una vasta gamma di linguaggi chimici (si veda la scheda ‘I sensi delle piante’Scheda in preparazione, è possibile che, nel caso specifico, non si tratti di vera e propria comunicazione tra individui, bensì della reazione di allontanamento da un ostacolo incontrato da un individuo.
Considerato che la ritrosia della chioma si manifesta anche quando questa viene a contatto con un ostacolo inanimato (ad esempio un muro), è presumibile che la natura del segnale sia tattile: quando la chioma viene ripetutamente toccata dall’ostacolo (ad esempio a seguito dell’ondeggiamento indotto dal vento) i germogli apicali interrompono la loro crescita su quel lato, mentre la chioma continua a svilupparsi sul lato opposto, inducendo così, gradualmente, la curvatura di allontanamento dei rami e/o del fusto (Fig. 22).
 Fig. 22. Esempi di ritrosia della chioma a contatto con altri pini (A) e con un ostacolo inanimato (la parete di un edificio) (B). A: i pini posti al perimetro della pineta (Marina di Carrara, via Genova), essendo cresciuti a distanza ravvicinata con quelli più interni, sono inclinati verso la strada poiché da questo lato la chioma non incontra ostacoli. B: i pini adiacenti al palazzo di via Don Minzoni sono cresciuti subverticali da giovani; in seguito, quando la chioma è giunta a toccare la facciata del palazzo, hanno sviluppato una manifesta curvatura di allontanamento (freccia bianca), presente su tutti gli esemplari alla stessa altezza. Sul lato opposto della strada, non essendovi ostacoli, la crescita è subverticale (freccia gialla).
Fig. 22. Esempi di ritrosia della chioma a contatto con altri pini (A) e con un ostacolo inanimato (la parete di un edificio) (B). A: i pini posti al perimetro della pineta (Marina di Carrara, via Genova), essendo cresciuti a distanza ravvicinata con quelli più interni, sono inclinati verso la strada poiché da questo lato la chioma non incontra ostacoli. B: i pini adiacenti al palazzo di via Don Minzoni sono cresciuti subverticali da giovani; in seguito, quando la chioma è giunta a toccare la facciata del palazzo, hanno sviluppato una manifesta curvatura di allontanamento (freccia bianca), presente su tutti gli esemplari alla stessa altezza. Sul lato opposto della strada, non essendovi ostacoli, la crescita è subverticale (freccia gialla).
D’altronde, checché ne dicano alcuni teorici del pollice verde, è noto che le piante non amino essere toccate. Nei primi anni ’90 Frank Salisbury per studiare le sostanze chimiche che inducevano la fioritura nella nappola minore (Xanthium strumarium), misurava con un righello l’incremento giornaliero di lunghezza delle foglie, ma si accorse che queste non raggiungevano mai la normale lunghezza e, proseguendo, ingiallivano e morivano.
Mark Jaffe riconobbe che questa inibizione della crescita indotta dal tatto è un fenomeno comune nella biologia vegetale e coniò il termine tigmomorfogenesiTigmomorfogenesi. Composto da tigma- ‘contatto’, morfo- ‘forma’ e -genesi ‘origine’: modificazione della forma e della struttura di un organo determinata da uno stimolo di contatto con un corpo estraneo..
Anche Arabidopsis thalianaArabidopsis thaliana, detta arabetta comune, è una piccola pianta della famiglia Crucifere (o Brassicacee), molto studiata poiché utilizzata come ‘organismo modello’ per le scienze vegetali (genetica, biologia molecolare e cellulare).
Tale scelta è dovuta alle sue piccole dimensioni, al rapido ciclo di sviluppo, alla facilità di ottenere piante transgeniche e alle dimensioni relativamente contenute del suo genoma (circa 5 milioni di paia di nucleotidi in soli 5 cromosomi) che ne ha consentito il sequenziamento e la creazione di mappe genetiche.
Da allora il punto focale della ricerca è diventato scoprire qual è la funzione di ognuno dei circa 26500 geni contenuti. (una specie di senape, detta ‘arabetta comune’), se toccata alcune volte al giorno, cresce più raccolta in se stessa e fiorisce molto più tardi. Di particolare interesse è il fatto che basta sfiorarne leggermente una foglia per indurre un rapido cambiamento dell’espressione genica della pianta.
La scoperta è avvenuta per caso: spruzzando l’ormone gibberellina sulle foglie di arabidopsis e controllando poi quali geni fossero stati attivati, si appurò che questi erano numerosi. Tuttavia si scoprì che la loro attività aumentava anche spruzzando altre sostanze, compresa addirittura l’acqua. Alla fine si capì che i geni rispondevano in realtà al trattamento fisico (al tocco delle goccioline sulle foglie); poiché la risposta si aveva anche solo toccando le foglie, i geni coinvolti vennero chiamati TCH (da TouCH, cioè tatto).
A ben pensarci, comunque, l’inibizione da contatto non è sorprendente (ma solo a posteriori), visto che le piante sono soggette a molte sollecitazioni tattili (vento, pioggia, neve, animali, rocce, altri alberi). Gli alberi sul crinale esposti a forti venti, ad esempio, si adattano limitando lo sviluppo dei rami e facendo crescere tronchi corti e spessi, mentre in una valle riparata crescono alti, sottili e pieni di rami.
D’altronde l’ipotesi dell’abrasione meccanica (che ridurrebbe l’attività delle gemme periferiche) era già stata suggerita negli anni ’50 per gli eucalipti in Australia.
Gli aghi: un capolavoro di risparmio idrico
Il pino, lo si è già detto, è una pianta moderatamente xerofilaXerofilo. Dal greco xerós ‘secco, arido’ e phílos ‘amico’: organismo che vive preferibilmente negli ambienti aridi., come le altre conifere. Ciò non significa che ‘esige’ habitat aridi, ma semplicemente che, grazie alla tolleranza all’aridità, riesce a insediarvisi proprio perché in ambienti così proibitivi viene meno la concorrenza di molte altre specie, ben più idroesigenti. Se piantato dall’uomo, infatti, si sviluppa benissimo anche in ambienti non aridi (purché le radici superficiali non siano sommerse).
D’altronde alle foglie delle conifere arriva sempre poca acqua, indipendentemente da quanta ve ne sia nel terreno, semplicemente perché i tessuti conduttori di queste piante hanno un’efficienza molto scarsa. Il loro legno, infatti, è costituito da fibrotracheidi areolate che svolgono una duplice funzione: quella di sostegno (svolta egregiamente) e quella di conduzione (svolta in maniera poco efficiente) (Fig. 23A).
Nelle Angiosperme (le piante a fiore), invece, la funzione di sostegno è affidata a cellule specializzate (le fibre) e quella di conduzione soprattutto a trachee che, avendo un maggior diametro ed essendo impilate l’una sull’altra a formare tubi continui senza setti divisori (o con setti ampiamente perforati), permettono un rifornimento idrico dalle radici ben più abbondante (Fig. 23B e 23C).
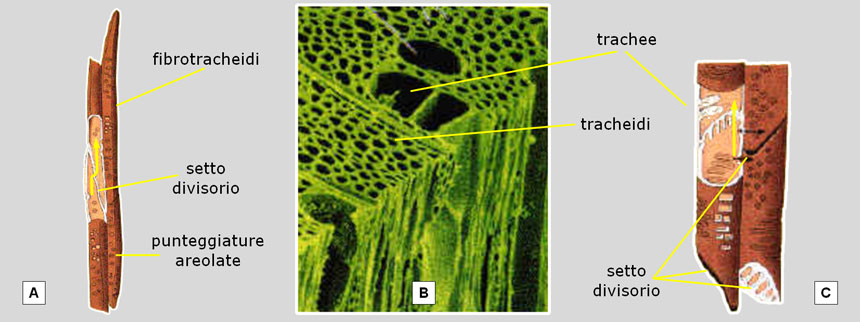 Fig. 23. Il legno delle conifere è costituito da fibrotracheidi, mentre nelle Angiosperme vi sono tracheidi, trachee e fibre (queste ultime specializzate nella funzione di sostegno). A: le fibrotracheidi sono cellule molto allungate, con parete piuttosto spessa (dovendo svolgere anche la funzione di sostegno), impilate l’una sull’altra ma separate da un setto molto obliquo. L’acqua proveniente dalle radici è costretta a passare da una cellula all’altra (verticalmente e lateralmente) attraverso minuscoli fori (punteggiature areolate) protetti da una membrana permeabile. Se si aggiunge che anche il piccolo diametro oppone resistenza al transito dei fluidi, ben si comprende perché la conduzione idrica sia così poco efficiente, insufficiente a compensare i livelli di traspirazione di molte piante. B: nel legno delle Angiosperme la conduzione idrica è affidata a tracheidi e, soprattutto, a trachee. C: la trachee (o ‘vasi’) hanno un maggior diametro e presentano pareti più sottili e con ampie perforazioni nel setto divisorio (talora assente) e nella parete laterale: sono quindi vasi conduttori molto più efficienti. Fonte delle illustrazioni: http://omodeo.anisn.it/omodeo/RST/trachee.htm.
Fig. 23. Il legno delle conifere è costituito da fibrotracheidi, mentre nelle Angiosperme vi sono tracheidi, trachee e fibre (queste ultime specializzate nella funzione di sostegno). A: le fibrotracheidi sono cellule molto allungate, con parete piuttosto spessa (dovendo svolgere anche la funzione di sostegno), impilate l’una sull’altra ma separate da un setto molto obliquo. L’acqua proveniente dalle radici è costretta a passare da una cellula all’altra (verticalmente e lateralmente) attraverso minuscoli fori (punteggiature areolate) protetti da una membrana permeabile. Se si aggiunge che anche il piccolo diametro oppone resistenza al transito dei fluidi, ben si comprende perché la conduzione idrica sia così poco efficiente, insufficiente a compensare i livelli di traspirazione di molte piante. B: nel legno delle Angiosperme la conduzione idrica è affidata a tracheidi e, soprattutto, a trachee. C: la trachee (o ‘vasi’) hanno un maggior diametro e presentano pareti più sottili e con ampie perforazioni nel setto divisorio (talora assente) e nella parete laterale: sono quindi vasi conduttori molto più efficienti. Fonte delle illustrazioni: http://omodeo.anisn.it/omodeo/RST/trachee.htm.
La scarsa capacità di rifornimento idrico delle conifere determina e spiega una serie di conseguenze. Le foglie sono costrette a una rigida economia d’acqua, che realizzano grazie alla riduzione del lembo: ecco perché le foglie sono aghiformi (nessuna conifera ha foglie con lembo largo come avviene, invece, nelle latifoglie).
Ma una lamina fogliare molto stretta e un apporto così limitato di acqua (materia prima indispensabile per la fotosintesi) comportano una scarsa efficienza della fotosintesi: ciò spiega perché, in generale, le conifere sono piante a crescita molto lenta. Tuttavia, laddove l’acqua non è scarsa, i pini mostrano una crescita piuttosto rapida poiché non hanno bisogno di mettere in atto i dispositivi di risparmio idrico (chiusura degli stomi e interruzione della fotosintesi).
D’altro canto la scarsa efficienza del tessuto conduttore impedisce ai pini di essere piante esigenti in umidità del suolo. Ciò consente loro di vivere in luoghi dai quali è davvero sorprendente che essi riescano a ottenere dell’acqua: si pensi alle alte scogliere marine, alle rupi e ai ghiaioni altoalpini, dove i pini sono di casa.
La limitata capacità di rifornimento idrico condiziona anche l’anatomia microscopica degli aghi, altamente specializzati nell’evitare anche la minima perdita d’acqua per traspirazione (Fig. 24A e 24B):
- gli aghi sono ricoperti da una spessa cuticola cerosa, perfettamente impermeabile;
- anche le cellule dell’epidermide, strettamente appressate e con la parete ispessita, sono corazzate contro la traspirazione;
- gli stomi (le uniche aperture attraverso le quali avvengono gli scambi gassosi) non sono direttamente esposti all’aria, ma sono collocati sulla parete di cavità infossate (cripte stomatiche) nelle quali l’aria e il vapor acqueo traspirato sono in stato di quiete e, pertanto, non sono soggetti al rapido allontanamento da parte del vento;
- il mesofillo (comprendente tutti i tessuti racchiusi dall’epidermide) è del tutto privo di spazi intercellulari; manca cioè il tessuto spugnoso che, anche nelle altre piante xerofile, consente all’anidride carbonica di raggiungere facilmente il tessuto clorofilliano (si confrontino le Fig. 24B e 24C).
È interessante notare che anche quest’ultimo accorgimento, pur riducendo le perdite idriche (rallentando la diffusione del vapor acqueo traspirato durante la fotosintesi), rallenta il rifornimento di anidride carbonica al tessuto clorofilliano e, pertanto, la fotosintesi e la stessa crescita della pianta.
È come se il pino, consapevole degli stringenti limiti delle sue capacità di approvvigionamento idrico, avesse deciso di far di necessità virtù: accettando una lenta crescita nei periodi siccitosi e spingendo al massimo gli accorgimenti di risparmio idrico è riuscito a trasformare il suo handicap nella capacità di primeggiare negli ostili ambienti aridi.
La strategia per superare i periodi critici estivi è la tolleranza allo stress idrico: subisce cioè lo stress (riducendo il turgore cellulare e l’attività fotosintetica) e recupera quando l’acqua è nuovamente disponibile. Anche questa capacità, tuttavia, ha un limite: il pino, infatti risente di siccità molto prolungate.
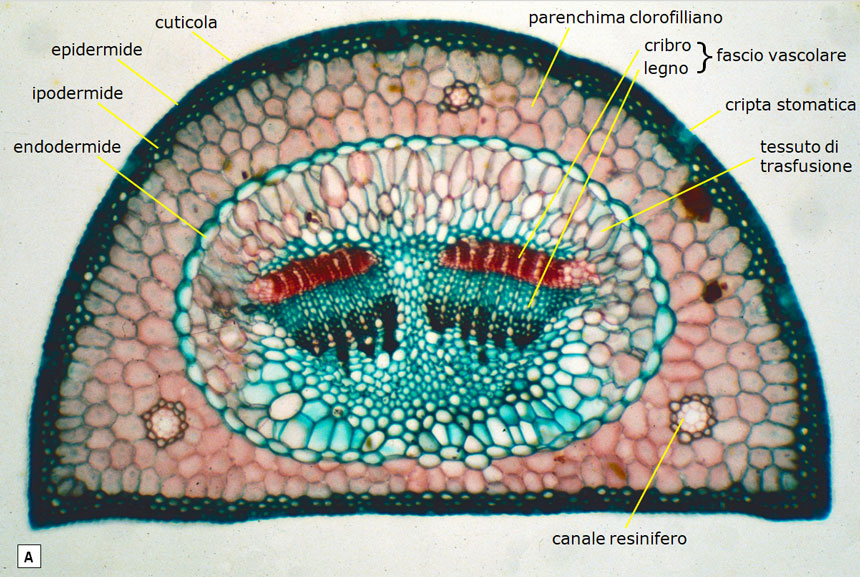
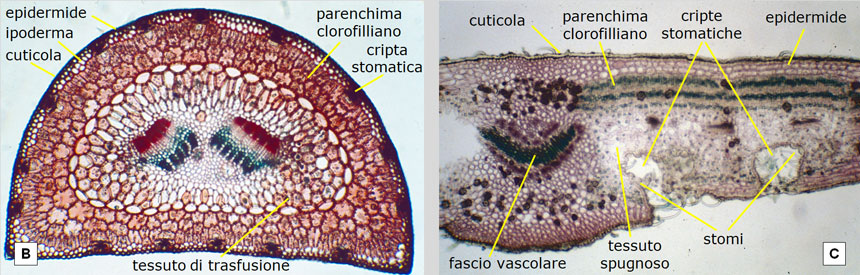 Fig. 24. Struttura di un ago di pino domestico (A e B) posta a confronto con quella di un’altra pianta xerofila (l’oleandro, in C): entrambe viste in sezione trasversale al microscopio, a 100 ingrandimenti. A e B: le cellule epidermiche del pino hanno una parete molto spessa (non è visibile, infatti, il lume cellulare) e sono coperte da cuticola cerosa che ne accresce l’impermeabilità. Gli stomi non sono sulla superficie dell’epidermide, ma all’interno di cripte stomatiche infossate, protetti in tal modo dalla ventilazione (che, allontanando il vapor acqueo, ne favorirebbe le perdite per traspirazione). Nei tessuti interni le cellule sono a stretto contatto tra loro, senza lasciare spazi intercellulari (manca cioè il tessuto spugnoso). Curiosità: grazie al loro rivestimento ceroso, le aperture delle cripte stomatiche sono percepibili anche ad occhio nudo poiché il loro allineamento si manifesta sotto forma di sottili linee bianche (si vedano le Fig. 2F e 3D). C: la foglia dell’oleandro, pur avendo anch’essa accorgimenti xerofili, ha cripte stomatiche con apertura ben più ampia (la ventilazione è attenuata da peli) e la circolazione gassosa interna (da e verso il parenchima clorofilliano) è facilitata dal tessuto spugnoso. In poche parole, la foglia del pino è più spiccatamente risparmiatrice d’acqua. D’altronde l’oleandro, sebbene spicchi per le sue rigogliose fioriture nei greti ciottolosi ed asciutti delle fiumare meridionali e degli uadi nordafricani nelle calde e secche estati (grazie agli accorgimenti adottati dalle sue foglie per limitare la traspirazione), può contare su maggiori disponibilità idriche poiché, pur esponendo il suo fogliame all’aria secca e ventosa, ama ‘tenere i piedi in acqua’. Le sue radici, infatti, si spingono in profondità nella falda, come rivela il suo nome latino Nerium (dal greco nerós o nerón = umido). Foto di: Legambiente Carrara.
Fig. 24. Struttura di un ago di pino domestico (A e B) posta a confronto con quella di un’altra pianta xerofila (l’oleandro, in C): entrambe viste in sezione trasversale al microscopio, a 100 ingrandimenti. A e B: le cellule epidermiche del pino hanno una parete molto spessa (non è visibile, infatti, il lume cellulare) e sono coperte da cuticola cerosa che ne accresce l’impermeabilità. Gli stomi non sono sulla superficie dell’epidermide, ma all’interno di cripte stomatiche infossate, protetti in tal modo dalla ventilazione (che, allontanando il vapor acqueo, ne favorirebbe le perdite per traspirazione). Nei tessuti interni le cellule sono a stretto contatto tra loro, senza lasciare spazi intercellulari (manca cioè il tessuto spugnoso). Curiosità: grazie al loro rivestimento ceroso, le aperture delle cripte stomatiche sono percepibili anche ad occhio nudo poiché il loro allineamento si manifesta sotto forma di sottili linee bianche (si vedano le Fig. 2F e 3D). C: la foglia dell’oleandro, pur avendo anch’essa accorgimenti xerofili, ha cripte stomatiche con apertura ben più ampia (la ventilazione è attenuata da peli) e la circolazione gassosa interna (da e verso il parenchima clorofilliano) è facilitata dal tessuto spugnoso. In poche parole, la foglia del pino è più spiccatamente risparmiatrice d’acqua. D’altronde l’oleandro, sebbene spicchi per le sue rigogliose fioriture nei greti ciottolosi ed asciutti delle fiumare meridionali e degli uadi nordafricani nelle calde e secche estati (grazie agli accorgimenti adottati dalle sue foglie per limitare la traspirazione), può contare su maggiori disponibilità idriche poiché, pur esponendo il suo fogliame all’aria secca e ventosa, ama ‘tenere i piedi in acqua’. Le sue radici, infatti, si spingono in profondità nella falda, come rivela il suo nome latino Nerium (dal greco nerós o nerón = umido). Foto di: Legambiente Carrara.
Dato l’adattamento agli ambienti aridi, può stupire che alcuni pini (es. pino mugo) e altre conifere (es. abete rosso e abete bianco) primeggino alle elevate altitudini e latitudini, dove l’acqua è spesso abbondante sotto forma di copertura nevosa.
Lo stupore però svanisce se si pensa che nel suolo gelato l’acqua è immobilizzata sotto forma di ghiaccio ed è perciò inutilizzabile dalle piante. Anche in queste condizioni aride e fredde, pertanto, i raffinati accorgimenti di risparmio idrico consentono a queste conifere di sopravvivere e, addirittura, di essere competitive.
Gli aghi: strumenti di una silenziosa guerra chimica
È esperienza comune l’osservazione che il suolo di una pineta è nudo (o, al più, con una modesta copertura erbacea), sebbene l’entità dell’ombreggiamento non sia tale da precludere la crescita di altre piante. Ciò non è un caso, ma il risultato dell’inibizione della crescita di plantule di altre specie ad opera di sostanze chimiche rilasciate dagli aghi caduti a terra.
In altre parole, il pino fa ‘terra bruciata’ al di sotto della sua chioma, consentendo la crescita solo di altri pini (qualora vengano a crearsi condizioni di luminosità sufficienti, ad esempio a seguito della caduta di un esemplare). Questo inquinamento del terreno è un caso, per nulla isolato, di ‘guerra chimica’ preventiva che elimina sul nascere possibili concorrenti. Altrettanto fanno, ad esempio, i ‘gas tossici’ emanati dagli eucalipti che eliminano tutta la vegetazione erbacea circostante.
D’altronde già nel 1956 Boris Tokin di Leningrado mostrò che una goccia di aghi di pino o abete triturati uccideva i protozoi in meno di un secondo e che nelle giovani foreste di conifere l’aria era quasi sterile grazie a sostanze ad attività antibiotica (fitoncidi) emanate dagli aghi.
Prodotti e sottoprodotti
Il legno, tenero, resistente all’umidità per la resina in esso contenuta, ma di qualità mediocre, è usato per imballaggi (es. pallet), travature e falegnameria andante e come combustibile (cippato, pellet, tronchetti pressati). Il suo principale uso industriale odierno è nei truciolati e nell’industria cartaria, ma in passato è stato largamente impiegato nelle costruzioni navali.
La resina, impastata con carbone e cera d’api, era usata dall’uomo preistorico per fissare le punte di freccia ad aste di legno. Per le sue proprietà adesive e sigillanti è eccellente per riparare vasellame incrinato; l’interno delle anfore elleniche era cosparso di resina (retzina) per assicurarne l’impermeabilità.
Ma è soprattutto in ambito navale che la resina (pece) ha rappresentato una risorsa irrinunciabile, per il suo potere sigillante («E Dio disse a Noè: fatti un’arca di legno di gofer, falla a stanze e trattala con pece, di dentro e di fuori» – Genesi 6:14). Per lungo tempo, infatti, è stata usata per sigillare le fessure delle imbarcazioni (calafataggio).
La raccolta della resina è sopravvissuta fino a pochi decenni fa. La resina grezza, in cui principale costituente è il limonene, è detta ‘trementina italiana’ se derivata dal pino domestico. Dalla sua distillazione si ottiene acqua ragia (detta anche ‘essenza di trementina’), usata come solvente per vernici, e colofonia (una resina solida, giallastra, trasparente, nota come ‘pece greca’, ‘resina per strumenti ad arco’), usata come pece da calafataggio.
A partire dall’Ottocento, con lo sviluppo dei primi sistemi razionali di gestione del bosco, si affermò l’impianto di pinete pure, vere e proprie monocolture e iniziò ad assumere importanza economica anche la raccolta dei pinoli: tra la fine dell’Ottocento e la prima metà del Novecento la Toscana era ai primi posti della produzione mondiale di pinoli.
Da un quintale di pigne sane si ricavano 20-25 kg di pinoli che, sgusciati, si riducono a 5-7 kg; ciò dà ragione dell’elevato prezzo dei pinoli al dettaglio (da 30 a oltre 100 €/kg, secondo la qualità). Le rese ordinarie in ‘mandorla’ (pinolo sgusciato commerciabile) si aggirano sui 150 Kg per ettaro, il che rende economicamente interessante la coltivazione.
Tuttavia negli ultimi decenni la produzione di pinoli è stata notevolmente compromessa dal ‘cimicione americano’ (Leptoglossus occidentalis) un insetto di recente introduzione in Italia che, penetrando le giovani pigne con i suoi stiletti boccali per nutrirsi della linfa, ne provoca l’aborto.
Anche la cocciniglia tartaruga del pino (Toumeyella parvicornis) danneggia i pini producendo un’abbondante lacrimazione di resina dagli aghi che ricopre il tronco conducendolo al disseccamento.
Oggi, pertanto, il consumo nazionale annuo di pinoli (circa 4.000 tonnellate) è soddisfatto solo in minima parte (200 t) dalla produzione nazionale. I pinoli usati in pasticceria e in altre produzioni alimentari sono dunque in massima parte di importazione (dal bacino del Mediterraneo, dal Pakistan e dalla Cina).
Pino marittimo? Non facciamo confusione!
La collocazione in prossimità del mare della maggior parte delle pinete, induce alcuni in errore: non è raro, infatti, sentir chiamare ‘pino marittimo’ il pino domestico. Si tratta di un errore da evitare con cura, anche perché il pino marittimo esiste davvero, ma è un’altra specie (Pinus pinaster).
Un’altra fonte di confusione deriva dal fatto che molto spesso nelle pinete litoranee sono presenti sia il pino marittimo che quello domestico. Le attuali pinete, infatti, sono state piantate principalmente come barriere frangivento, per consentire le coltivazioni agricole proteggendole dai venti marini e dal salmastro da essi trasportato.
Data la maggior resistenza al salmastro del pino marittimo e la sua predilezione per il substrato francamente sabbioso, la struttura tipica delle pinete costiere è costituita da una prima fascia di pini marittimi seguita, verso l’interno, da una seconda fascia di pini domestici.
Poiché anche le pinete di Marina di Carrara conservano questa struttura, esse si prestano egregiamente a imparare a distinguere a colpo d’occhio le due specie. A tal fine, basarsi sulla forma ad ombrella della chioma del pino domestico non è la soluzione migliore visto che spesso, nelle pinete, i pini non sono sufficientemente distanziati da permetterne il pieno sviluppo. È quindi preferibile utilizzare i caratteri distintivi più semplici: le screpolature della corteccia e la forma delle pigne.
Le pigne sono coni a base larga nel pino domestico (Fig. 25A) e coni più stretti, fusiformi, nel pino marittimo (Fig. 25B). La corteccia alla base del tronco presenta scaglie molto allungate e profondamente screpolate nel pino domestico e scaglie ovalari, sottili e grigie nel pino marittimo (Fig. 25 C, D e E).

 Fig. 25. Distinzione tra pino domestico e pino marittimo (pineta di Marina di Carrara, presso l’Internazionale Marmi e Macchine). Le pigne sono coniche a base larga nel pino domestico (A) e più strette e allungate, fusiformi nel pino marittimo (B). Nel pino domestico la corteccia alla base del tronco è screpolata in scaglie molto lunghe e spesse, di colore dal rosa al roso mattone e al grigio (C); è dunque ben diversa da quella del pino marittimo che si screpola in squame ovalari con margine irregolare, sottili e di colore grigio (D). Nei rami, invece, la corteccia delle due specie è più difficilmente distinguibile. E: il diverso aspetto della corteccia permette il facile riconoscimento delle due specie, anche a distanza. La corteccia grigia con scaglie piuttosto indistinte dei pini marittimi (posti a sinistra del sentiero, il lato più prossimo al mare) è infatti ben distinguibile da quella con grosse scaglie allungate dei pini domestici (a destra del sentiero).
Fig. 25. Distinzione tra pino domestico e pino marittimo (pineta di Marina di Carrara, presso l’Internazionale Marmi e Macchine). Le pigne sono coniche a base larga nel pino domestico (A) e più strette e allungate, fusiformi nel pino marittimo (B). Nel pino domestico la corteccia alla base del tronco è screpolata in scaglie molto lunghe e spesse, di colore dal rosa al roso mattone e al grigio (C); è dunque ben diversa da quella del pino marittimo che si screpola in squame ovalari con margine irregolare, sottili e di colore grigio (D). Nei rami, invece, la corteccia delle due specie è più difficilmente distinguibile. E: il diverso aspetto della corteccia permette il facile riconoscimento delle due specie, anche a distanza. La corteccia grigia con scaglie piuttosto indistinte dei pini marittimi (posti a sinistra del sentiero, il lato più prossimo al mare) è infatti ben distinguibile da quella con grosse scaglie allungate dei pini domestici (a destra del sentiero).La matematica delle pigne
La natura mostra una curiosa preferenza per certe architetture a spirale e per i numeri della successione di FibonacciFibonacci. Detto Leonardo Pisano, è tra i più grandi matematici del Medioevo (circa 1175-1235). Ha contribuito più di ogni altro a introdurre, nell’Europa medievale, il sistema di numerazione indo-arabo, da allora universalmente adottato nel mondo occidentale. Per studiare la discendenza di una coppia di conigli ideò una serie numerica (detta perciò successione) in cui ogni numero è uguale alla somma dei due precedenti: 0, 1, 1, 2, 3, 5, 8, 13 ecc., una successione numerica in cui ogni numero (dopo i primi due) è uguale alla somma dei due precedenti: 0, 1, 1, 2, 3, 5, 8, 13, 21, 34 ecc. Una particolarità di questa sequenza è che il rapporto tra due termini successivi tende rapidamente a 1,61803…, noto come rapporto aureo.
I numeri di Fibonacci e le spirali auree (o logaritmiche) sono presenti in numerose forme naturali: ne sono esempi la struttura del DNA, quella degli uragani e delle galassie, la coclea dell’orecchio, le geometrie della ragnatela, molte conchiglie, le onde del mare che si infrangono a riva, il volo di uccelli in formazione ecc. Ciò dipende dalla possibilità di un processo di crescita in cui si conservano costantemente i rapporti e si mantengono equilibri vitali.
In biologia ritroviamo questi rapporti nella disposizione dei fiori nell’infiorescenza delle composite (ad es. nel girasole si contano 21 spirali in senso orario o antiorario e 34 in senso opposto; con l’accrescimento si passa a 34 e 55, fino al record di 144 e 233). Del tutto simile è la geometria del frutto dell’ananas e delle pigne di conifere: la pigna tipica ha 5 spirali che ruotano in direzione oraria e 8 nel verso opposto, ma si possono raggiungere 8 e 13 spirali (Fig. 26).
 Fig. 26. Una pigna particolarmente grande, con 8 spirali in senso orario e 13 in senso antiorario. Fonte: https://blogdimatematicaescienze.it/le-pigne-e-i-numeri-di-fibonacci/
Fig. 26. Una pigna particolarmente grande, con 8 spirali in senso orario e 13 in senso antiorario. Fonte: https://blogdimatematicaescienze.it/le-pigne-e-i-numeri-di-fibonacci/
– Vai all’elenco delle schede già pubblicate
Aggiornamenti: 13/12/2021

Vuoi collaborare?
Puoi farlo segnalandoci l’ubicazione precisa nel comune di Carrara di esemplari di questa (o di altre) specie meritevoli di particolare interesse per uno o più motivi: dimensioni, età, portamento, ecc.
Scrivi a info@legambientecarrara.it un messaggio con oggetto “Piante ornamentali”; precisa il nome (volgare e/o scientifico) della specie, l’ubicazione (via e numero civico, nome del parco, o altro). Se possibile, unisci una mappa (ad es. di Google Earth) con un segnaposto che indichi l’esatta localizzazione dell’esemplare o, se del caso, il numero di esemplari presenti.
Potremo così gradualmente realizzare una mappa che indichi tutti i punti del territorio comunale in cui sono presenti esemplari della specie particolarmente meritevoli di segnalazione. Grazie.
Mappa in corso di completamento: centra sull’area di interesse (spostandoti con il mouse tenendo premuto il pulsante destro), ingrandisci (col + in basso a sinistra) e, per aprire la legenda, clicca sul quadratino in alto a sinistra.



